|
高考化学必考知识点《有关氧化还原反应的计算》试题强化练习(2019年最新版)(八)
2019-06-28 22:05:10
【 大 中 小】
|
1、选择题 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
|
参考答案:D
本题解析:A、n(Cu)×64 g/mol+n(Mg)×24 g/mol=1.52 g ①;当金属离子全部沉淀时根据关系式:Cu—2e---Cu2+--Cu(OH)2--2OH-得:n(e-)=n(OH-)=(2.54 g-1.52 g)/17g·mol-1="0.06" mol,故2[n(Cu)+n(Mg)]=0.06 mol ②,由①②解得n(Cu)=0.02 mol,n(Mg)=0.01 mol,故A正确。B、已知浓硝酸密度为1.40g/mL、质量分数为63.0%,由公式Mc=1000ρω计算得c=14.0mol/L,故B正确。C、NO2和N2O4混合气体的物质的量为1.12L/22.4L·mol-1=0.05mol,即
n(NO2)+n(N2O4)=0.05mol ③
由电子守恒:
n(NO2)×1+n(N2O4)×2=0.06mol ④
由③④解得
n(NO2)=0.01mol n(N2O4)=0.04mol,
NO2的体积分数=0.04/0.05×100%=80%,
显然C正确、D、由题意得生成2.54 g沉淀时,消耗0.06 mol NaOH,其体积为0.06mol/1.0 mol·L-1=0.06L,即60ml,故D错误。
考点:理解溶液中溶质的质量分数的概念,并能进行有关计算,了解金属与硝酸的反应及进行相关计算。
点评:涉及多步连续反应的化学计算题常用关系式法;金属与硝酸反应的相关计算往往利用氮原子守恒、得失电子守恒解题。
本题难度:一般
2、选择题 根据以下反应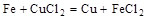 ,? ,?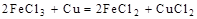 , 判断: , 判断: 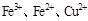 氧化性强弱的顺序是? 氧化性强弱的顺序是?
A.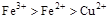
B.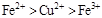
C.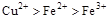
D.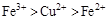
参考答案:D
本题解析:该题利用氧化性的强弱顺序:氧化剂>氧化产物;
分析第一个反应:CuCl2是氧化剂(铜由+2价降低到0价,被还原),FeCl2是氧化产物(铁由0价升高到+2价,被氧化);分析第二个反应:FeCl3是氧化剂(铁由+3价降低到+2价,被还原),CuCl2是氧化产物(铜由0价升高到+2价,被氧化);故选D
本题难度:一般
3、选择题 下列物质在工业生产中,其主要反应不涉及氧化还原反应的是
A.烧碱
B.纯碱
C.硫酸
D.硝酸
参考答案:B
本题解析:A、电解饱和食盐水制得;B、侯式制碱法主要是利用物质溶解度的差异制得,发生的主要是复分解反应;C、工业制硫酸主要是氧化硫铁矿或单质硫;D、工业制硝酸主要是氨的催化氧化。
本题难度:一般
4、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
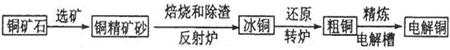
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
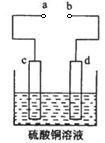
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
参考答案:(1)Cu2S、FeS(每空1分);2FeS+3O2 2FeO+2SO2(缺少条件的扣1分) 2FeO+2SO2(缺少条件的扣1分)
(2)2/3mol(3分,没有单位或单位错误扣1分)
(3)正(1分),Fe-2e-=Fe2+;Cu-2e-=Cu2+(4分,每个方程式2分)
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管。缺少一个要点不得分)。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
本题解析:(1)Cu的低价为+1价,Fe的低价为+2价,所以两种低价硫化物的化学式分别为Cu2S、FeS;Fe的硫化物转化为低价氧化物,FeS与O2反应生成FeO和SO2,配平可得化学方程式:2FeS+3O2 2FeO+2SO2。 2FeO+2SO2。
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
(3)c为粗铜板,为阳极,则a端应连接电源的正极;Fe的活泼性大于Cu,所以阳极即c电极Fe和Cu失电子,发生反应的方程式为:Fe-2e-=Fe2+;Cu-2e-=Cu2+。
(4)碱式滴定管含有橡皮管,易被强氧化剂氧化而老化,酸性高锰酸钾具有强氧化性,所以不能用碱式滴定管盛酸性高锰酸钾溶液;MnO4?在酸性条件下把Fe2+氧化为Fe3+,MnO4?被还原为Mn2+,根据化合价升降法配平可得离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴定时,锥形瓶中的溶液会接触空气,空气中的O2能氧化Fe2+,所以酸性高锰酸钾溶液用量减少,测得铁元素的含量会偏低。
本题难度:一般
5、选择题 下列说法正确的是
A.水溶液中或融熔状态下能导电的化合物是电解质,已知化合物SO3的水溶液能导电,由此判断SO3属于电解质;
B.一定温度和压强下,各种 气态物质体积的大小,主要由气体的物质的量决定; 气态物质体积的大小,主要由气体的物质的量决定;
C.2mol水的摩尔质量与1mol水的摩尔质量之比为2:1;
D.在化学反应中某元素化合价只升高,则反应过程中该元素被还原了。
参考答案:B
本题解析:略
本题难度:一般
|