1、选择题 做实验要注意安全.若用混入碳粉的二氧化锰与氯酸钾混合加热制取氧气会发生爆炸,因此在实验前要除去混在二氧化锰中的碳粉,其方法是将混入碳粉的二氧化锰
A.加热到碳粉烧尽
B.用水溶解、过滤、除去碳粉
C.用水溶解,再蒸馏除去碳粉
D.用NaOH溶液溶解碳粉
参考答案:A
本题解析:用燃烧法除C将其转化成CO2.
本题难度:困难
2、选择题 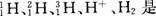
A.氢的五种同位素
B.五种氢元素
C.氢的五种核素
D.氢元素的五种不同微粒
参考答案:D
本题解析:这五种微粒是氢元素的五种不同微粒,故选D
本题难度:简单
3、选择题 A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子的氧化性比B的阳离子的氧化性弱,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则它们的原子半径由大至小的顺序是
A.D>C>B>A? B.A>B>C>D
C.B>A>C>D? D.A>B>D>C
参考答案:B
本题解析:A、B、C、D四种元素可假设为K、Ca、S、Cl,这对解析具体问题更加直观。
本题难度:简单
4、填空题 碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为?;Al与NaOH溶液反应的离子方程式为
?。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为?。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g)?△H<0?
Si3N4(s) + 12HCl(g)?△H<0?
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是??mol/(L·min)。
②平衡时容器内N2的浓度是?mol·L-1。
③SiCl4(g)的转化率是?。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应?(填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是(? )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
参考答案:(1) ?
?
2Al +2OH-+2H2O = 2AlO2 + 3H2↑?
(2)Si3N4 +16HF = 3SiF4 + 4NH4F?
(3)①0.024?②0.06?③40%?④不变 ⑤? C
本题解析:(1)Al的原子结构示意图为 ,Al与NaOH溶液反应的离子方程式为2Al +2OH-+2H2O = 2AlO2 + 3H2↑;
,Al与NaOH溶液反应的离子方程式为2Al +2OH-+2H2O = 2AlO2 + 3H2↑;
(2)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,这种铵盐是NH4F,该反应的化学方程式为Si3N4 +16HF = 3SiF4 + 4NH4F?;
(3)①Si3N4(s)的质量是5.60g,所以的物质的量n=5.60/80=0.04mol,根据
3SiCl4(g) + 2N2(g) + 6H2(g)  Si3N4(s) + 12HCl(g),可知
Si3N4(s) + 12HCl(g),可知
V(H2)="6" V(Si3N4)=6×(0.04/2/5)="0.024" mol/(L·min);②反应的N2的物质的量n=0.04×2=0.08mol,所以平衡时容器内N2的浓度=(0.2-0.08)/2="0.06" mol·L-1;
③SiCl4(g)的转化率是=0.04×3/0.3×100%=40%;④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,因为这个投料比为化学计量数之比,所以SiCl4(g)的转化率应该不变;⑤由SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)可以知道,压强增大,反应向左进行,所以减小压强能提高SiCl4的转化率,故A错误;若反应开始时SiCl4为1mol,达到平衡时,由于该反应为可逆反应,所以吸收热量小于QkJ,故B错误;C正确,反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.015mol/(L·min),故D也错误,本题答案为C。
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)可以知道,压强增大,反应向左进行,所以减小压强能提高SiCl4的转化率,故A错误;若反应开始时SiCl4为1mol,达到平衡时,由于该反应为可逆反应,所以吸收热量小于QkJ,故B错误;C正确,反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.015mol/(L·min),故D也错误,本题答案为C。
点评:本题综合考查了原子结构示意图、离子方程式、化学平衡的综合知识,是高考考查的重点,该题比较全面,是一道不错的题目。
本题难度:一般
5、选择题 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 。下列比较中正确的是:
。下列比较中正确的是:
A.原子半径:a>c>d>b
B.电负性a>b>d>c
C.原子序数:d>a>c>b
D.最高价含氧酸的酸性c>d>a
参考答案:D
本题解析:略
本题难度:简单