1、选择题 已知阿伏加德罗常数的值为NA,则下列说法正确的是
A.1?mol/L?CuCl2溶液中含有的Cl-的个数为2NA
B.14?g?CnH2n中含有的共用电子对数为NA
C.常温常压,46?gNO2与N2O4的混合气体中含有的原子数为3NA
D.4.6?g?Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于O.1NA
参考答案:C
本题解析:分析:A、氯化铜溶液的体积不知,无法计算氯化铜的物质的量;
B、14 g CnH2n中含有0.1molCH2,共用电子对数一定多于0.1mol;
C、46 gNO2与N2O4的混合气体中相当于含有1molNO2,含有3mol原子;
D、钠的物质的量是0.2mol,反应生成了0.1molNa2O、Na2O2的混合物,阴离子为0.1mol.
解答:A、题中没有告诉氯化铜溶液的物质的量,故无法计算溶液中氯离子的个数,故A错误;
B、CnH2n的分子中含有碳氢、碳碳共用电子对,故 14 g CnH2n中含有的共用电子对数大于NA,故B错误;
C、由于46 gNO2与N2O4的混合气体分子组成可以看成含有1molNO2,故含有的原子数为3NA,故C正确;
D、根据钠原子守恒,4.6g钠是0.2mol,生成了0.1molNa2O、Na2O2的混合物,阴离子为0.1mol,故D错误;
故选C.
点评:本题考查阿伏伽德罗常数,注意溶液的浓度和体积都告诉,才能计算溶质的物质的量,本题难度中等.
本题难度:简单
2、选择题 下列因素中,与气体体积的大小关系不大的是
A.气体的分子数
B.温度
C.压强
D.分子大小
参考答案:D
本题解析:分析:影响物质体积的因素有微粒数目、分子本身大小以及分子间的距离.温度、压强决定气体分子间距.
解答:影响物质体积的因素有微粒数目、分子本身大小以及分子间的距离等因素,温度、压强决定气体分子间距.对于气体来说,气体分子间的距离远大于分子本身的大小,分子本身可以忽略不计.
故选:D.
点评:本题考查影响气体气体体积大小的因素,题目难度不大,注意在同温同压下,气体分子间的平均距离相等,与气体的种类无关,影响气体气体体积的主要因素是气体的分子数.
本题难度:简单
3、选择题 由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是
A.2 :3 :5
B.2 :5 :5
C.2 :1 :5
D.2 :2 :7
参考答案:D
本题解析:混合气体的平均式量为16×2=32,而混合气体中氧气的式量恰好也为32,只需要H2和CO2的平均式量为32即可,由十字交叉法可知二者的物质的量之比为2:5,所以答案为D
本题难度:简单
4、选择题 NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下2.24L三氯甲烷含有分子数目为0.1NA
B.标准状况下1.8?g?H2O含有分子数目为0.1NA
C.3.2?g硫与铜充分反应,电子转移总数为0.1NA
D.常温下,100mL?lmol/L的Na2CO3溶液中的阴离子数目大于0.1NA
参考答案:BD
本题解析:分析:A、标准状况三氯甲烷不是气体;
B、依据n=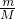 =
=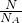 ,计算得到分子数;
,计算得到分子数;
C、硫和铜反应生成硫化亚铜;依据n=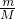 ,结合氧化还原反应计算电子转移;
,结合氧化还原反应计算电子转移;
D、水溶液中碳酸根离子水解;
解答:A、标准状况下三氯甲烷不是气体,2.24L三氯甲烷不是0.1mol,含有分子数目不是0.1NA,故A错误;
B、1.8 g H2O物质的量为0.1mol,含有分子数目为0.1NA,故B正确;
C、3.2 g硫物质的量为0.1mol,与铜充分反应,2Cu+S=Cu2S,S~Cu2S~2e-,电子转移总数为0.2NA,故C错误;
D、常温下,100mL lmol/L的Na2CO3溶液中碳酸根离子物质的量0.1mol,碳酸根离子水解,CO32-+H2O?HCO3-+OH-,溶液中的阴离子数目大于0.1NA,故D正确;
故选BD.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,盐类水解的分析,氧化还原反应的电子转移计算,注意碳酸根离子水解阴离子增多,题目难度中等.
本题难度:一般
5、选择题 同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A.密度比为1:1
B.密度比为11∶16
C.体积比为11∶16
D.体积比为16∶11
参考答案:C
本题解析:同温同压下,气体的密度之比是气体的摩尔质量之比,所以SO2和CO2的密度之比是64︰44=16︰11,A、B都不正确;在质量相等的条件下,气体的体积之比是气体的摩尔质量之比的反比,即44︰64=11︰16,C正确,D不正确,答案选C。
本题难度:简单