1、填空题 (14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
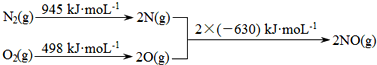
则该反应的热化学方程式为_____________________________。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积_____________________L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJ?mol-1
CH3OH(g);△H= -b kJ?mol-1
①该反应的平衡常数表达式为_____________________________。
②若容器容积不变,下列措施可增加甲醇产率的是______________
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2