1、实验题 课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确_________________?
参考答案:(1)CH3CHO+2Ag(NH3)2OH  CH3COONH4+2Ag↓+H2O+3NH3
CH3COONH4+2Ag↓+H2O+3NH3
(2)检测溴水与褪色后溶液的酸、碱性,若酸性明显增强,则猜想①正确,反之猜想②正确。
本题解析:
本题难度:一般
2、实验题 下图装置测定中和热的实验步骤如下:
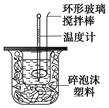
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)?。
(2)倒入NaOH溶液的正确操作是?(从下列选出)。
A.沿玻璃棒缓慢倒入? B.分三次少量倒入? C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是?(从下列选出)。
A.用温度计小心搅拌? B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
| 温度差平均值(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 29.5
| ?
|
2
| 25.9
| 25.9
| 25.9
| 29.2
|
3
| 26.4
| 26.2
| 26.3
| 29.8
|
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=?(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)?。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H2SO4溶液的温度
参考答案:(1)H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)?ΔH=-57.3 kJ/mol·
(2)C? (3)D? (4) ①3.4?②-56.8 kJ/mol?③ac
本题解析:(1)中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量,所以热化学方程式为H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l)?ΔH=-57.3 kJ/mol·。
(2)为减少热量的损失,应该迅速倒入,答案选C。
(3)温度计不能用来搅拌,BC容易造成热量的损失,所以正确的答案选D。
(4)①实验1、2、3中温差分别是3.4℃、3.3℃、3.5,所以温度差平均值3.4℃.
②氢氧化钠过量,反应中生成水是0.025mol,所以△H=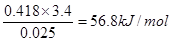 。
。
③测定结果偏低,说明热量有损失,所以答案选ac。
本题难度:简单
3、实验题 (共7分)欲配制 250 mL0.1 mol·L-1的NaOH溶液,回答下列问题:
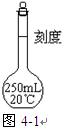
(1)写出图4-1仪器的名称??,使用此仪器前要检查它是否?。
(2)用托盘天平称取NaOH固体的质量?g。
(3)转移溶液时,应将已冷却的NaOH溶液沿??注入右图所示的仪器中。
(4)若称量前NaOH已部分潮解,则配制的溶液的浓度?(偏大或偏小)。
(5)在配制该NaOH溶液时必须用到的实验仪器是(填序号)?。(2分)
①500mL的量筒 ②烧杯 ③托盘天平 ④250mL的容量瓶 ⑤玻璃棒
⑥1000mL的容量瓶 ⑦胶头滴管 ⑧250mL的量筒
参考答案:(1)容量瓶,漏水;(3)玻璃棒;(4)偏小
(2)1.0; (5)②③④⑤⑦
本题解析:略
本题难度:一般
4、实验题 (12分)在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
⑴实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要?、?。
为了减少实验误差:实验过程中将NaOH溶液?(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的?,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式?。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=??kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g)?△H=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l)? △H=-571.6 kJ·mol-1
H2(g)+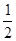 O2(g) = H2O(g)? △H=-241.8 kJ·mol-1
O2(g) = H2O(g)? △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为?kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) ?△H=?kJ·mol-1
参考答案:(12分)
⑴温度计 ?环形玻璃搅拌棒 ?一次 ?最高温度? (各1分)
CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
⑵ -9? 285.8?-392.8?(每空2分)
本题解析:①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要温度计 ?环形玻璃搅拌棒。
为了减少实验误差:实验过程中将NaOH溶液一次倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的最高温度,记为终止温度。
②实验测定在一定温度下,0.2 molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33 kJ的热量。该反应的热化学方程式CH4(g)+2H2O(g) =CO2(g)+4H2(g) △H=+165.0 kJ·mol-1。
⑵通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。
则反应H2(g)+I2(g)=2HI(g)的反应热△H=436kJ+153kJ-2×299kJ=-9? kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g)?△H1=-90.8 kJ·mol-1。
已知:2H2(g)+ O2(g) = 2H2O (l)? △H2=-571.6 kJ·mol-1
H2(g)+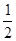 O2(g) = H2O(g)? △H3=-241.8 kJ·mol-1
O2(g) = H2O(g)? △H3=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为285.8kJ·mol-1;
CH3OH(g)+O2(g) = CO(g)+2H2O(g) ?△H=-△H1-△H2+2△H3=-392.8kJ·mol-1。
点评:此题要求学生熟悉中和热的测定实验:包括实验过程,实验仪器,实验数据分析等等;盖斯定律也是常考的题目,使用该定律要注意:
1、盖斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同;
2、热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
3、各步反应均不做非体积功。
4、各个涉及的同一物质应具有相同的聚集状态。
5、化学反应的反应热(△H)只与反应体系的始态或终态有关,而与反应途径无关。
本题难度:一般
5、选择题 下列实验操作或检验正确的是

A.收集氯气
B.转移溶液
C.模拟工业制备并检验氨气
D.用海水制少量蒸馏水
参考答案:D
本题解析:略
本题难度:一般