1、简答题 请按要求完成下列各题:
(1)MgCl2的电子式是______;丙氨酸的结构简式是______.
(2)1gC2H2完全燃烧生成CO2和液态水,放出49.94kJ热量.乙炔在氧气中完全燃烧的热化学方程式是______.
(3)在一定条件下,分子式为C3H4O2的羧酸和某醇反应生成分子式为C5H8O2的酯,写出该反应的化学方程式(有机物写结构简式,下同)______.
(4)在一定条件下,乙烯和丙烯按1:1的物质的量比反应生成聚乙丙烯的化学方程式是______.
(5)依据酸碱质子理论,HCO3-可以看作是______.
参考答案:(1)镁失去2个电子形成阳离子,氯原子得到电子形成阴离子,电子式为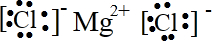 ;丙氨酸的结构简式为
;丙氨酸的结构简式为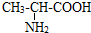 ,
,
故答案为: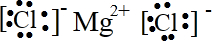 ;
;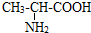 ;
;
(2)1gC2H2在氧气中燃烧生成CO2和液态水,放出49.94kJ热量,26g即1molCH4在氧气中燃烧生成CO2和液态水,放出1294.8kJ热量,
则热化学方程式为:C2H2(g)+52O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol,
故答案为:C2H2(g)+52O2(g)═2CO2(g)+H2O(l)△H=-1294.8kJ/mol;
(3)C3H4O2的羧酸和某醇反应生成分子式为C5H8O2的酯,该反应的化学方程式:CH2=CHCOOH+CH3CH2OH催化剂
本题解析:
本题难度:一般
2、选择题 下列说法中错误的是(?)
A.若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.CO2与SiO2晶体熔化时,所克服的微粒间相互作用相同
D.短周期元素离子aXm+和bYn-具有相同的电子层结构,则a>b
参考答案:C
本题解析:A项正确;B项C2H5OH分子间存在氢键,沸点高,正确;C项CO2克服分子间作用力,SiO2晶体是原子晶体,克服的是共价键;D项aXm+和bYn-具有相同的电子层结构,说明X在Y的下一周期,则a>b,正确。
点评:分子晶体的熔沸点决定于相对分子质量,但是有氢键的熔沸点要大很多,属于简单题。
本题难度:一般
3、选择题 下列有关化学键与晶体结构说法正确的是
[? ]
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
参考答案:D
本题解析:
本题难度:简单
4、选择题 根据下列微粒结构示意图的共同特征,可以把三种微粒归为一类。下列微粒中可以归为此类的微粒是
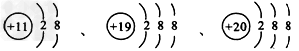
[? ]
A.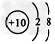
B.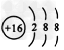
C.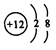
D.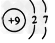
参考答案:C
本题解析:
本题难度:简单
5、简答题 现有下列短周期元素性质的数据:
?元素编号
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧
原子半径
(10-10m)
0.74
1.02
1.52
1.10
0.99
1.86
0.75
1.43
|
最高或最
低化合价
+6
+1
+5
+7
+1
+5
+3
-2
-2
-3
-1
-3
|
回答下列问题:
(1)元素③在周期表中位置是______;?元素④与元素⑦相比较,气态氢化物较稳定的是______(填化学式);
(2)元素①是______(写元素符号),元素⑥是______(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为______;
(3)元素⑤与元素②的非金属性强弱顺序为______(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为______;
(4)用电子式表示元素①氢化物的形成过程______;写出元素⑦氢化物的电子式______;写出实验室制元素⑤单质的化学反应方程式______.
参考答案:+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;⑧最高正价+3价,无负价,只能是IIIA族元素,而原子半径⑧>④,故⑧只能是位于第三周期第IIIA族的Al元素;①②的最低负价为-2价,①无正价,则①应为第二周期的O元素,②最高正价+6价,为第三周期的S元素,则
(1)③为Li元素,原子序数为3,核外有2个电子层,最外层电子数为1,位于周期表第二周期ⅠA族,非金属性:N>P,则氢化物较稳定的是?NH3,
故答案为:第二周期ⅠA族;NH3;
(2)①为Na元素,⑥为O元素,二者按照原子个数比为1:1形成的化合物为Na2O2,与水反应生成NaOH和O2,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:O;?Na;2Na2O2+2H2O=4NaOH+O2↑;
(3)同周期元素从左到右元素的非金属性逐渐增强,则非金属性Cl>S,Cl2通入H2S的水溶液中发生氧化还原反应生成HCl和S,反应的方程式为Cl2+H2S=2HCl+S↓,
故答案为:Cl>S;Cl2+H2S=2HCl+S↓;
(4)①的氢化物为H2O,用电子式表示的形成过程为
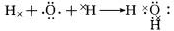
,⑦的氢化物为,属于共价化合物NH3,电子式为
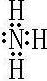
,实验室由浓盐酸和MnO2在加热条件下发生反应制备氯气,反应的化学方程式为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,
故答案为:
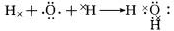
;
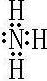
;MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O.
本题解析:
本题难度:一般