1、选择题 在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应: 2A(g)+B(g)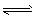 3C(g)+D(g),达到平衡时C的浓度为ωmol/L。若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为ωmol/L的是
3C(g)+D(g),达到平衡时C的浓度为ωmol/L。若维持体积和温度不变,按下列四种方式加入起始量,达平衡后,C仍为ωmol/L的是
[? ]
A. 4mol A+2mol B
B. 2mol A+1mol B+3mol C+1mol D
C. 3mol C+1mol D+1mol B
D.3mol C+1mol D
参考答案:D
本题解析:
本题难度:一般
2、简答题 在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)

?2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙
初始投料
2molSO21molO2
2molSO3
4molSO22molO2
平衡时n(SO3)
1.6mol
n2
n3
反应的能量变化
放出Q1kJ
吸收Q2kJ
放出Q3kJ
体系的压强
P1
P2
P3
反应物的转化率
α1
α2
α3
|
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c与b、c间应满足的代数关系式为______、______.
(2)该温度下此反应的平衡常数值为______,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正______V?逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是______
A.α1+α2=1?B.Q1+Q2=196?C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol?F.Q3=2Q1
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是______或______.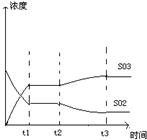
参考答案:(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,
则amolSO2、bmolO2和cmolSO3相当于2molSO2和1molO2,达到同一平衡状态,
则? 2SO2(g)+O2(g)

?2SO3(g)
状态1:2mol? 1mol? 0
状态2:amol? bmol?cmol
则应有a+c=2,b+c2=1,
故答案为:a+c=2;?b+c2=1;
(2)达到平衡时,平衡时n(SO3)=1.6mol,
则? ?2SO2(g)+O2(g)

?2SO3(g)
起始:2mol? 1mol? 0
转化:1.6mol? 0.8mol? 1.6mol
平衡:0.4mol?0.2mol? 1.6mol
则:k=c2(SO3)c2(O2)×c2(SO2)=1.620.42×0.2=80,
若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,
则Qc=0.320.12×0.1=90>80,平衡向逆反应方向移动,则正反应速率小于逆反应速率,
故答案为:80;<;
(3)甲容器反应物投入2molSO2、1molO2与乙容器反应物投入2mol SO3在保持恒温、恒容情况下是等效平衡,平衡时SO3的物质的量n2=1.6mol、p1=p2、α1+α2=1、Q1+Q2能量总变化相当于2molSO2、1molO2完全转化成2mol SO3的能量,即吸放热Q1+Q2数值上就等于196kJ;甲容器反应物投入量2molSO2、1molO2与丙容器反应物投入量4molSO22molO2,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向逆向移动,也就是说,丙容器的转化率比甲容器还要低一些.
因此α1+α2=1、Q1+Q2=196;α3>α1;P3<2P1=2P2、n3<n2<3.2mol、Q3>2Q1,故答案为:ABD;
(4)t2时平衡向正反应方向移动,三氧化硫浓度增大,二氧化硫浓度减小,可减低温度或充入氧气能实现反应的转化关系,
故答案为:降低温度;充入氧气.
本题解析:
本题难度:一般
3、填空题 I. 恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气)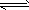 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为________mol。
(2)若开始时放入3 molA和3molB,到达平衡后,生成C的物质的量为________mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x=
______ mol,y=________mol。平衡时,B的物质的量________(选填一个编号)
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较_______(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是____________________。
参考答案:(1)(1-a)
(2)3a
(3)2;3-3a;丁;若 ,B的物质的量小于2mol,若
,B的物质的量小于2mol,若 ,B的物质的量等于2mol,若
,B的物质的量等于2mol,若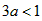 ,B的物质的量大于2mol (4)
,B的物质的量大于2mol (4)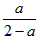 (5)乙;因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后。
(5)乙;因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后。
本题解析:
本题难度:一般
4、填空题 在体积恒定的密闭容器中,充入3 mol A 和1 mol B发生反应3A(g)+B(g)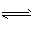 xC(g),达到平衡后,C 在平衡混合气体中的体积分数为φ。若维持温度不变,按 1.2 mol A.0.4 mol B、0.6 mol C为起始物质,
xC(g),达到平衡后,C 在平衡混合气体中的体积分数为φ。若维持温度不变,按 1.2 mol A.0.4 mol B、0.6 mol C为起始物质,
(1)若达到平衡后 C的体积分数仍为φ,则x值是____;
(2)若达到平衡后压强不变,C的体积分数仍为φ,则x值是___。
参考答案:(1)1或4
(2)1
本题解析:
本题难度:一般
5、选择题 在密闭容器内,N2和H2起始的物质的量分别为10mol、30mol,达到平衡时N2的转化率为25%。若从NH3开始,在相同条件下欲使平衡时各成分的百分含量相同,则应加入NH3的物质的量及NH3的转化率为
[? ]
A.15mol和25%
B.20mol和50%
C.20mol和75%
D.40mol和80%
参考答案:C
本题解析:
本题难度:一般