1、选择题 下列说法正确的是( )
A.制取水泥和玻璃的原料中均有纯碱
B.普通玻璃是电的绝缘体,这种透明的固体物质是混合物,并有固定的熔点
C.等物质的量的?SiO2与CaCO3在高温下锻烧,残留物为一纯净物
D.水泥具有水硬性,在空气中能硬化,但在水中不能硬化
参考答案:C
本题解析:
本题难度:简单
2、填空题 (16分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
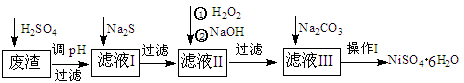
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____? ________?。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: ? 。
(5)操作Ⅰ包括以下过程:过滤,用?(填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。
参考答案:(1)S2-+Cu2+= CuS↓(3分)?(2)减少过氧化氢的分解(3分)
(3)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O(3分)
(4)Na2SO4? NiSO4 (4分,漏选得1分,错选不给分)?(5)H2SO4(3分)
本题解析:(1)硫化铜是难溶于水的沉淀,反应原理是复分解反应,方程式为S2-+Cu2+= CuS↓。
(2)双氧水不稳定,受热易分解,所以温度不能太高的原因是减少过氧化氢的分解。
(3)氧化剂氯酸钠的还原产物是氯化钠,转移6个电子,所以根据电子得失守恒可知,方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。
(4)由于经过前面的除杂,Cu、Zn、Fe、Cr等杂质均以沉淀的形式而被过滤出来,所以滤液中的主要成分是Na2SO4、NiSO4。
(5)为了减少NiSO4的溶解,洗涤时应该用硫酸。
本题难度:一般
3、填空题 钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe.Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
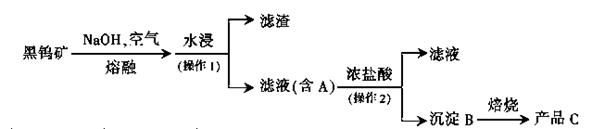
其中A、B、C都是钨的化合物。回答:
(1)碱熔时,钨酸亚铁转化为氧化铁和钨酸钠,写出相应反应的化学方程式____。
(2)操作2的名称是?,实验室中证明沉淀B是否洗净的方法是?;实验室中焙烧需要的主要仪器有____;
(3)写出用氢气还原氧化钨制取金属钨的化学方程式;?;为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,因为____。
(4)某种蓝色氧化钨的化学式可以表示为WO2.8,一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这五价钨与六价钨的原子数目之比为?:_? ___。
参考答案:(16分,(1、4)各3分,其余每空2分)
(1)4FeWO4+8NaOH+O2 4Na2WO4+2Fe2O3+4H2O
4Na2WO4+2Fe2O3+4H2O
(2)过滤,取最后一次洗涤液,滴加硝酸酸化后再滴入硝酸银溶液;酒精灯、坩埚、泥三角、铁架台或三角架
(3)WO3+3H2 W+3H2O
W+3H2O
氢气还原时氢气和生成的水不会成为钨中的杂质,而用碳还原时生成的钨中可能会含有碳杂质。
(4)2:3
本题解析:本题为一全新的知识,在解题过程中要学会接受知识,加以整合应用。钨在化合物中为+6价,且以钨酸盐的形式存在,这些性质与锰有些类似。
(1)根据反应物为FeMnO4、O2、NaOH,生成物为Na2WO4、Fe2O3可以写出反应方程式。
(2)从操作后产物来看为滤液和固体,故操作为过滤,检验是否洗净,关键看附着的为什么离子,然后检验这种离子的存在。
(3)为氢气还原钨的过程
(4)设+5价和+6价分别为x、y;有5x+6y=2×2.8,x+y=1,解得x:y=2:3。
本题难度:一般
4、填空题 (10分)
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
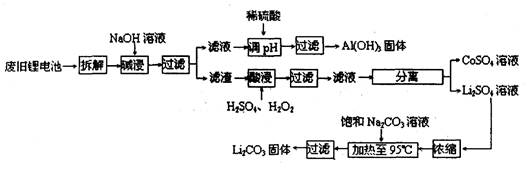
(1)上述工艺回收到的产物有?
(2)Li原子的最外层电子数是?,废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是___________________________________________
(3)碱浸时主要反应的化学方程式为?。
(4)最后一步过滤应趁热过滤,原因是?
参考答案:(1)LiCoO2、Al(OH)3、CoSO4
(2)1,隔绝空气和水
(3)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
(4)防止析出硫酸钠晶体。
本题解析:(1)根据流程图可知,回收到的产物有Al(OH)3、CoSO4和Li2CO3。(2)Li是3号元素,最外层一个电子。锂与钠为同一主族,易与水和氧气反应,所以要隔绝空气和水(3)碱浸时,只有铝箔能跟NaOH反应。Na2CO3与LiSO4反应生成Li2CO3沉淀和Na2SO4溶液,Na2SO4溶液冷却会析出固体,所以要趁热过滤。
本题难度:一般
5、选择题 下列不属于海水化学资源利用的是( )。
A.海水淡化
B.海水提盐
C.海水提溴
D.海水提碘
参考答案:A
本题解析:海水淡化是海水水资源的利用,而海水提盐、海水提溴、海水提碘等均是海水化学资源的利用。
本题难度:简单