1、填空题 目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
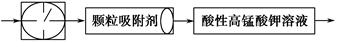
①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
参考答案:(1)托盘天平 药匙 烧杯 200 mL容量瓶 胶头滴管 搅拌和引流
(2)5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(3)防止可吸入颗粒堵塞导气管或进入酸性高锰酸钾溶液中,使测量质量不准 吸收前后颗粒吸附剂、棉花、盛放容器的总质量(或将装置用编号表示回答,或答颗粒吸附剂、棉花、盛放容器的总质量的增加值)
(4)通入气流速率过快,二氧化硫未和酸性高锰酸钾溶液充分反应就已经被排出
本题解析:(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液属于用固体溶质配制一定浓度的溶液,故需托盘天平、药匙、烧杯、200 mL容量瓶、胶头滴管等,在配制溶液过程中玻璃棒在溶解过程中用于搅拌加速溶解,转移溶液时起引流作用。
(2)SO2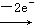 SO42-,MnO4-
SO42-,MnO4- Mn2+。由电子守恒、电荷守恒和元素守恒的次序即可配平方程式。
Mn2+。由电子守恒、电荷守恒和元素守恒的次序即可配平方程式。
本题难度:简单
2、选择题 下列关于赤潮发生的原因叙述正确的是( )。
A.含氯化合物直接排入大海,引发赤潮的发生
B.含氮、磷元素的大量污水直接排入大海,导致某些浮游生物爆发性繁殖
C.赤潮发生的根本原因是含氟制冷剂大量使用导致臭氧层破坏的结果
D.空气中二氧化碳浓度升高,导致海洋温度升高,引发了赤潮的发生
参考答案:B
本题解析:赤潮是由于水体中氮、磷元素含量过多,导致营养过剩造成的。故选B项。
本题难度:简单
3、选择题 自2008年6月1日起,在超市等场所禁用塑料袋。下列有关说法不正确的是 (?)
A.少用塑料袋能保护环境
B.少用塑料袋能节约资源
C.塑料及其制品都属于混合物
D.白色塑料造成了白色污染
参考答案:D
本题解析:略
本题难度:简单
4、选择题 糖类、油脂、蛋白质是人类重要的营养物质。下列说法不正确的是
A.葡萄糖跟新制的氢氧化铜反应生成砖红色沉淀
B.油脂在碱性条件下水解生成甘油和高级脂肪酸
C.蛋白质水解的最终产物是氨基酸
D.欲将蛋白质从水中析出而又不改变它的性质,可加入Na2SO4溶液
参考答案:B
本题解析:A项葡萄糖跟新制的氢氧化铜在加热条件下反应生成Cu2O砖红色沉淀,正确;B项油脂在碱性条件下,发生皂化反应,生成甘油和高级脂肪酸钠,错误;C项正确;D项欲将蛋白质从水中析出而又不改变它的性质,一般采用盐析法,加入轻金属盐如Na2SO4、NH4SO4溶液等。
点评:从三类营养物质的官能团总结其化学性质。属于简单题。
本题难度:简单
5、选择题 下列对某些合成材料,如 91eXaM.org塑料制品废弃物的处理方法正确的是(? )
A.将废弃物混在垃圾中填埋在土壤里
B.将废弃物焚烧
C.将废弃物用化学方法加工成涂料或汽油
D.将废弃物倾倒在海洋中
参考答案:C
本题解析:由塑料制品废弃物引起的污染叫“白色污染”。由于塑料的性质很稳定,很难分解,造成的污染在相当长的时间内难以消除。最好的办法是回收,再进一步加工成汽油或其他有用产品。
本题难度:一般