| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子共存》答题技巧(2019年最新版)(八)
参考答案:C 本题解析:A、酸性溶液中,CO32-与H+反应生成二氧化碳和水,不能大量共存,错误;B、Fe2+为浅绿色,所以不符合题意,错误;C、酸性溶液中这四种离子都可以大量共存,正确;D、OH-与H+反应生成水,不能大量共存,错误,答案选C。 本题难度:一般 3、选择题 某无色透明的溶液中,下列各组离子能大量共存的是 |
参考答案:C
本题解析:
试题解析:氢离子和碳酸根生成二氧化碳和水,故A错误;银离子和碘离子生成碘化银沉淀,故B错误;C共存;含铁离子的溶液呈棕黄色,故D错误。
考点:离子共存
本题难度:一般
4、选择题 在指定环境中,下列各组离子一定可以大量共存的是( )
A.使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B.滴加无色酚酞试液后仍无色的溶液中:CO32-、K+、ClO-、AlO2-
C.在c(H+)/c(OH-)=1×1012的溶液中:NH4+、Ca2+、C1-、K+
D.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42-
参考答案:A.使pH试纸呈红色的溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,则离子不能共存,故A错误;
B.滴加无色酚酞试液后仍无色的溶液,显酸性,H+分别与CO32-、ClO-、AlO2-反应,则离子不能大量共存,故B错误;
C.在c(H+)/c(OH-)=1×1012的溶液,c(H+)=0.1mol/L,溶液显酸性,该组离子之间不反应,则能共存,故C正确;
D.加入铝粉后产生大量氢气的溶液,为酸或强碱溶液,酸溶液中H+与Al、NO3-发生氧化还原反应不生成氢气,碱溶液中OH-与NH4+结合,则不能共存,故D错误;
故选C.
本题解析:
本题难度:一般
5、填空题 (12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A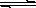 H++HA-,? HA-
H++HA-,? HA-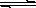 H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液?
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是?,最小的是?。?
(2)c(H2A)最大的是?,最小的是?。
(3)c(A2-)最大的是?,最小的是?。
参考答案:(12分) (填代号):
(1)c(H+)最大的是? A?,最小的是? D?。
(2)c(H2A)最大的是 C?,最小的是 D?。
(3)c(A2-)最大的是 D?,最小的是 A?。
本题解析:0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液HCL与NaHA反应:NaHA+HCl=NaCl+H2A,所以C中相当于含有 0.01mol/LH2A 和0.01mol/LNaHA;0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有 0.01mol/LNa2A,因此,
A、0.01mol/L的H2A溶液 B、0.01mol/L的NaHA溶液
C、0.01mol/LH2A 和0.01mol/LNaHA D、0.01mol/LNa2A
(1)因弱酸的一级电离为酸性的主要来源,明显只有A、C具有弱酸;而C中HA-会抑制同浓度弱酸的电离,故较小,只有D为正盐,水解程度最大,c(H+)最小,故答案为:A;D;
(2)因C中电离比A小,留下的就比A大,故c(H2A)最大;D中正盐二级水解生成弱酸最难,故c(H2A)最小,故答案为:C;D;
(3)因正盐留下的A2-浓度必最大;弱酸二级电离成A2-最难,故答案为:D;A.
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《大气污染与.. | |