1、选择题 常温下,下列各组溶液中的离子一定能大量共存的是
[? ]
A.中性溶液中:K+、Al3+、Cl-、HCO3-
B.强碱性溶液中:ClO-、Ca2+、Mg2+、NO3-
C.pH=2的溶液中:Fe2+、SO42-、K+、NO3-
D.酸性溶液中:NH4+、Cl-、Na+、SO42-
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列各组离子一定能大量共存的是
[? ]
A.在含大量Fe3+的溶液中: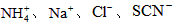
B.在强碱性溶液中: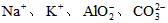
C.在pH=1的溶液中: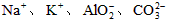
D.在无色透明溶液中: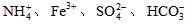
参考答案:B
本题解析:
本题难度:一般
3、选择题 有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大,将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀。经检验,三种正盐中还含有下列选项中的一种离子,该离子是
A、Na+ B、Mg2+ C、Cu2+ D、Ag+
参考答案:D
本题解析:生成一种白色沉淀,从给出的5种离子少了一种阳离子说明完全沉淀,白色沉淀不可能是硫酸盐(因为等物质的量正盐,如果是硫酸盐那么硫酸根离子就没有剩余)只能是氯化银,又根据阴、阳离 子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序)B只能是硝酸银,氯离子有剩余所以A应是氯化铁,C既是硫酸钾,选D。
考点:考查离子反应和定量分析.
本题难度:一般
4、选择题 下表叙述中,评价合理的是( )
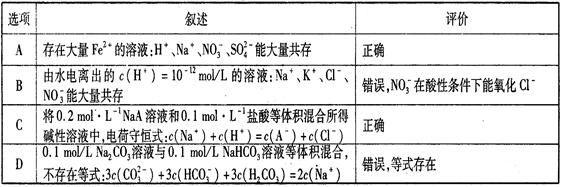
参考答案:D
本题解析:A、H+、NO3?能氧化Fe2+,不能大量共存,错误;B、NO3?不能在酸性条件下氧化Cl?,评价错误;C、所得溶液还含有OH?,电荷守恒式应为:c(Na+)+c(H+)=c(A-)+c(Cl?)+c(OH?),错误;D、0.1mol?L?1 Na2CO3和0.1mol?L?1 NaHCO3溶液等体积混合,钠元素与碳元素对应关系为2n(Na)=3n(C),混合后存在CO32?、HCO3?和H2CO3,所以等式:3c(CO32?)+3c(HCO3?)+3c(H2CO3)=2c(Na+)成立,正确。
考点:本题考查离子的推断、电荷守恒、物料守恒。
本题难度:困难
5、选择题 在下列各组溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:Na+、K+、SO42-、AlO2-
B.含有0.1mol?L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN-
C.无色透明溶液中:HCO3-、Na+、Cl-、OH-
D.与铝反应生成H2的溶液中:Na+、Cu2+、Cl-、SO42-
参考答案:A、强碱性溶液存在大量的OH-,该组离子在碱性溶液中不反应,则一定能大量共存,故A正确;
B、因Fe3+与SCN-能结合生成络离子,则一定不能大量共存,故B错误;
C、因HCO3-、OH-能结合生成碳酸根离子和水,则一定不能大量共存,故C错误;
D、与铝反应生成H2的溶液可能为酸或碱的溶液,若溶液为碱性,则OH-能与Cu2+结合生成沉淀,则一定不能大量共存,故D错误;
故选A.
本题解析:
本题难度:简单