1、填空题 合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g)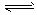 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)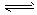 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
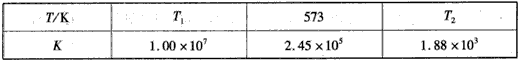
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
(3)673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。

A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
参考答案:(1)①1; ②50%
(2)<
(3) ACD
(4)充入空气,NO转化为NO2,NO2继续与水反应生成HNO3,有利于提高原料利用率
(5) CH4(g)+2NO2(g)==CO2(g)+2H2O(g)+N2(g) △H= -867 kJ·mol-1
本题解析:
本题难度:一般
2、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图

已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1mol FeS2放出热量为853 kJ,则FeS2燃烧的热化学方程式为_________________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为______________________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为______________________(任写一个)。
(4)通过“操作I”可以得到亚硫酸钠品体,写出主要操作步骤的名称:______________。
(5)硫酸生产中炉气转化反应为:2SO2(g)+O2(g) 2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO3(g)。研究发现,SO3的体积分数(SO3%) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
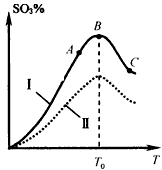
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)=v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s) △H= -3412 kJ/mol
(2)SO2+Na2CO3=Na2SO3+CO2↑(或2SO2+Na2CO3+H2O=NaHSO3+CO2↑)
(3)Fe3++3OH-=Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
本题解析:
本题难度:一般
3、填空题 在硫酸的工业生产中,通过下列反应使SO2转化为SO3:2SO2(g)+O2(g) 2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:
2SO3(g) △H <0。已知常压下SO3体积分数为91%,试回答:
(1)在生产中常用过量的空气是为了_____。
(2)加热到400℃~500℃是由于____。
(3)压强应采用____(填“高压”或“常压”)。原因是_____。
(4)常用质量分数为98. 3%的浓H2SO4来吸收SO3,而不是用水,是因为____。
(5)尾气中的SO2必须回收是因为____。
参考答案:(1)提高SO2的转化率
(2)此时催化剂的活性最大
(3)常压 ;因为常压下SO2的平衡转化率(SO3的体积分数91%)已经很高了,若加压则带来一些不必要的设备和动力上的投入
(4)防止形成酸雾,不利于SO3的吸收
(5)防止大气污染,形成酸雨
本题解析:
本题难度:一般
4、选择题 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如图).按此密闭体系中气体的流向,则在A处流出的气体为( )
A.SO2
B.SO3,O2
C.SO2,SO3
D.SO2,O2