|
|
|
高中化学知识点大全《化学平衡》考点特训(2019年冲刺版)(二)
2019-06-28 22:44:42
【 大 中 小】
|
1、选择题 对于C(s)+H2O(g)?CO(g)+H2(g),的描述正确的是( )
A.达平衡时,各反应物和生成物浓度相等
B.增大压强,对此反应平衡状态无影响
C.达平衡时,C(H2O):C(CO)=1:1
D.达平衡时,H2O转化为CO的速率等于CO转化为H2O的v
参考答案:A、达到平衡状态,各组分的浓度不变,但是不一定各反应物和生成物浓度相等,故A错误;
B、该反应是体积增大的反应,增大压强,平衡向着逆向移动,故B错误;
C、达到平衡状态,各组分的浓度不再变化,不一定满足c(H2O):c(CO)=1:1,故C错误;
D、达到化学平衡状态,正逆反应速率相等,所以H2O转化为CO的速率等于CO转化为H2O的速率,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 下列措施中,一定能使化学平衡移动的是( )
A.改变温度
B.改变压强
C.使用催化剂
D.改变容器体积
参考答案:A、反应一定有热效应,改变温度一定使平衡发生移动,故A正确;
B、对于反应前后气体的物质的量不发生变化的可逆反应,改变压强平衡不移动,对于反应前后气体体积变化的反应可逆反应,改变压强平衡发生移动,故B错误;
C、催化剂同等程度改变正、逆反应速率,平衡不移动,故C错误;
D、改变容器的体积,即改变了压强,对于反应前后气体的物质的量不发生变化的可逆反应,改变压强平衡不移动,对于反应前后气体体积变化的反应可逆反应,改变压强平衡发生移动,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) υ(b)>υ(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
| 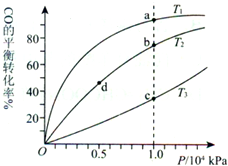
参考答案:C
本题解析:
本题难度:简单
4、简答题 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为?c(A)=1.0mol/L,c(B)=2.0mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______;
(2)实验②平衡时B的转化率为______;
(3)该反应的△H______0(填>”或<”)(4)该反应进行到10min时的平均反应速率:______(以③计算).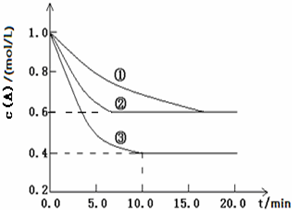
参考答案:(1)与①比较,②反应速率增大,但与①处于同一平衡状态,则②应为加入催化剂,与①比较,③反应速率增大,可能是升高温度或增大压强,但如是增大压强,减小容器的体积虽然平衡向正反应方向移动,但A的平衡浓度反而增大,不符合图象,则应为升高温度,
故答案为:加催化剂;升高温度;
(2)实验②平衡时B的转化率为1.0mol/L-0.6mol/L1.0mol/L×100%=40%,
故答案为:40%;
(3)由图象③可以看出,升高温度,A的浓度降低,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,
故答案为:>;
(4)该反应进行到10min时的平均反应速率为:v=△c△t=1.0mol/L-0.4mol/L10min=0.06mol/(L?min),
故答案为:0.06?mol/(L?min).
本题解析:
本题难度:一般
5、选择题 (18分)自然界中化合态硫主要以FeS2(黄铁矿)、CuFeS2(黄铜矿)等矿物形式存在。用黄铜矿炼铜的总反应为: 。 。
(1)该反应中_______元素被还原,如果在反应中生成1molCu,转移电子数为____(用NA表示阿伏加德罗常数)。
(2)上述产生的SO2是一种大气污染物,不能直接排放到大气中,目前工业上常用的处理方法有多种。
I、用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
①写出上述转化中生成NH4HSO3的化学方程式_______(用一个方程式表示)若想提高该过程中SO2的除去速率,可采取的措施为_______(填序号)
A.增大氨水浓度
B.升高反应温度
C.使气体与氨水充分接触
D.通入空气使HSO3-转化为SO42-
|
②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是_______(用离子方程式表示),若水解常数用Kb表示,则该溶液中铵根离子的水解常数Kb约为______________.
Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2
③当n(NaOH):n(SO2)=_______时,吸收SO2的成本最低,所得吸收液中各离子浓度大小关系是_______,向吸收液中加入NaOH可得到_______。
参考答案:(1)Cu、O,12NA。
(2)①SO2+NH3+H2O NH4HSO3; AC。
NH4HSO3; AC。
②5×10—10。
③1:1, c(Na+)>c(HSO3—) >c(H+)>c(SO32—) >c(OH-), Na2SO3。
本题解析:(1)反应 中铜元素的化合价由+2价降为0价,氧元素的化合价由0价降为—2价,化合价降低被还原,Cu、O元素被还原,转移的电子数为24,如果在反应中生成1molCu,转移电子数为12NA。(2) I、①用氨水将SO2转化为NH4HSO3的化学方程式为SO2+NH3+H2O
中铜元素的化合价由+2价降为0价,氧元素的化合价由0价降为—2价,化合价降低被还原,Cu、O元素被还原,转移的电子数为24,如果在反应中生成1molCu,转移电子数为12NA。(2) I、①用氨水将SO2转化为NH4HSO3的化学方程式为SO2+NH3+H2O NH4HSO3;若想提高该过程中SO2的除去速率,可采取的措施为增大氨水浓度,使气体与氨水充分接触,选AC。 ②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是NH4++H2O
NH4HSO3;若想提高该过程中SO2的除去速率,可采取的措施为增大氨水浓度,使气体与氨水充分接触,选AC。 ②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是NH4++H2O NH3·H2O+H+,该溶液中铵根离子的水解常数Kb="[" NH3·H2O][ H+]/[ NH4+]=10—5×10—5/0.2=5×10—10。 Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2 ③当n(NaOH):n(SO2)=1:1时,消耗的氢氧化钠的物质的量最少,吸收SO2的成本最低,所得吸收液为亚硫酸氢钠溶液,溶液呈酸性,亚硫酸氢根的电离程度大于其水解程度,各离子浓度大小关系是c(Na+)>c(HSO3—) >c(H+)>c(SO32—) >c(OH-),向吸收液中加入NaOH可得到Na2SO3。
NH3·H2O+H+,该溶液中铵根离子的水解常数Kb="[" NH3·H2O][ H+]/[ NH4+]=10—5×10—5/0.2=5×10—10。 Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2 ③当n(NaOH):n(SO2)=1:1时,消耗的氢氧化钠的物质的量最少,吸收SO2的成本最低,所得吸收液为亚硫酸氢钠溶液,溶液呈酸性,亚硫酸氢根的电离程度大于其水解程度,各离子浓度大小关系是c(Na+)>c(HSO3—) >c(H+)>c(SO32—) >c(OH-),向吸收液中加入NaOH可得到Na2SO3。
考点:考查氧化还原反应,化学方程式的书写和盐类的水解等。
本题难度:困难

 NH4HSO3; AC。
NH4HSO3; AC。 中铜元素的化合价由+2价降为0价,氧元素的化合价由0价降为—2价,化合价降低被还原,Cu、O元素被还原,转移的电子数为24,如果在反应中生成1molCu,转移电子数为12NA。(2) I、①用氨水将SO2转化为NH4HSO3的化学方程式为SO2+NH3+H2O
中铜元素的化合价由+2价降为0价,氧元素的化合价由0价降为—2价,化合价降低被还原,Cu、O元素被还原,转移的电子数为24,如果在反应中生成1molCu,转移电子数为12NA。(2) I、①用氨水将SO2转化为NH4HSO3的化学方程式为SO2+NH3+H2O NH4HSO3;若想提高该过程中SO2的除去速率,可采取的措施为增大氨水浓度,使气体与氨水充分接触,选AC。 ②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是NH4++H2O
NH4HSO3;若想提高该过程中SO2的除去速率,可采取的措施为增大氨水浓度,使气体与氨水充分接触,选AC。 ②25℃时0.lmol·L—1 (NH4)2SO4溶液的pH=5,其原因是NH4++H2O NH3·H2O+H+,该溶液中铵根离子的水解常数Kb="[" NH3·H2O][ H+]/[ NH4+]=10—5×10—5/0.2=5×10—10。 Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2 ③当n(NaOH):n(SO2)=1:1时,消耗的氢氧化钠的物质的量最少,吸收SO2的成本最低,所得吸收液为亚硫酸氢钠溶液,溶液呈酸性,亚硫酸氢根的电离程度大于其水解程度,各离子浓度大小关系是c(Na+)>c(HSO3—) >c(H+)>c(SO32—) >c(OH-),向吸收液中加入NaOH可得到Na2SO3。
NH3·H2O+H+,该溶液中铵根离子的水解常数Kb="[" NH3·H2O][ H+]/[ NH4+]=10—5×10—5/0.2=5×10—10。 Ⅱ、“钠碱法”:用NaOH溶液作吸收剂吸收SO2 ③当n(NaOH):n(SO2)=1:1时,消耗的氢氧化钠的物质的量最少,吸收SO2的成本最低,所得吸收液为亚硫酸氢钠溶液,溶液呈酸性,亚硫酸氢根的电离程度大于其水解程度,各离子浓度大小关系是c(Na+)>c(HSO3—) >c(H+)>c(SO32—) >c(OH-),向吸收液中加入NaOH可得到Na2SO3。