|
高中化学知识点大全《化学平衡》考点特训(2019年冲刺版)(八)
2019-06-28 22:44:42
【 大 中 小】
|
1、选择题 有一化学平衡mA(g)+nB(g)?PC(g)+qD(g),右图表示A的转化率与压强、温度的关系.由此得出的正确结论是( ) 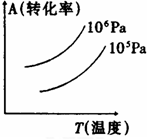
A.正反应是吸热反应
B.(m+n)<(p+q)
C.压强增大,A的转化率减小
D.温度升高,A的转化率减小
|
参考答案:A
本题解析:
本题难度:一般
2、选择题 COCl2俗名光气,是有毒气体。在一定条件下,可发生的化学反应为:
 。下列有关说法正确的是 。下列有关说法正确的是
[? ]
A.?在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.?当反应达平衡时,恒温恒压条件下通入Ar,化学反应速率不变
C.?单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态
D.?恒温恒容下,充入1mol光气达到平衡后,再充入等量的CO与Cl2,光气的体积分数增大
参考答案:D
本题解析:
本题难度:一般
3、填空题 已知:25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HClO)=3.0×10-8,Ka(HF)=
3.5×10-4,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)25℃时,将10 mL pH =1的CH3COOH溶液和10 mL pH =1的HF溶液分别与10 mL 0.1mol/L的NaHCO3溶液混合。
①画出产生的气体体积(V)随时间(t)变化的示意图。
②反应结束后所得的两溶液中,c(CH3COO-)_______c(F-)(填“>”、“<”或“=”)。
(2)25℃时,将少量CO2通入足量NaClO中,写出该反应的离子方程式_________,此反应的平衡常数K=
________________。
(3)0.18 mol/LCH3COONa溶液的pH为____。
参考答案:(1)①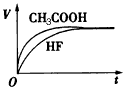 ②> ②>
(2)CO2+H2O+ClO=HCO3-+ HClO;14.3
(3)9
本题解析:
本题难度:一般
4、选择题 在地壳内,深度每增加lkm,压强大约增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响。如:
CaAl2Si2O8 + Mg2SiO4 CaMg2Al2Si3O12 CaMg2Al2Si3O12
(钙长石) (镁橄榄石) (钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2. 70 3.22 3.50
在地壳区域变质的高压条件下,有利于
[? ]
A.钙长石生成
B.镁橄榄石生成
C.钙长石和镁橄榄石共存
D.(钙镁)石榴子石生成
参考答案:D
本题解析:
本题难度:一般
5、选择题 将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),某温度下发生反应:Ag2SO4(s)  Ag2O(s)+SO3(g),2 SO3(g) Ag2O(s)+SO3(g),2 SO3(g)  2 SO2(g)+ O2(g),反应经过10 min达到平衡,测得c(SO3)=0.4mol/L,c(SO2)=0.1mol/L,则下列叙述中不正确的是( ) 2 SO2(g)+ O2(g),反应经过10 min达到平衡,测得c(SO3)=0.4mol/L,c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
A.这10 min内氧气的平均反应速率为0.005 mol·mol-1·min-1
B.SO3的分解率为20%
C.容器里气体的密度为40g/L
D.硫酸银与三氧化硫的化学反应速率相同
参考答案:D
本题解析:平衡时c(SO2)=0.1mol/L,则根据反应的方程式可知,氧气的浓度是0.05mol/L,所以氧气的反应速率是0.05mol/L÷10min=0.005 mol·mol-1·min-1,选项A正确;根据c(SO3)=0.4mol/L,c(SO2)=0.1mol/L可知,三氧化硫的最初浓度是0.5mol/L,所以三氧化硫的分解率是0.1÷0.5=0.2,即为20%,选项B正确;平衡时容器里气体的密度为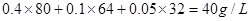 ,选项C正确;硫酸银是固体,不能表示反应速率,选项D不正确,答案选D。 ,选项C正确;硫酸银是固体,不能表示反应速率,选项D不正确,答案选D。
本题难度:一般
|