1、选择题 “嫦娥1号”卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是 ( )
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化
参考答案:B
本题解析:负极氧化正极还原,Ag2O-------2Ag化合价降低被还原,为正极。
本题难度:一般
2、选择题 结合右图判断,下列叙述正确的是
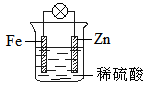
A.正极被保护
B.H+向Zn电极移动
C.加入少量KSCN溶液,变血红色
D.负极的电极反应式是:Fe-2e-=Fe2+
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铁活泼,所以锌是负极,铁是正极,溶液中的氢离子在正极得到电子,所以只有选项A正确,其余都是错误的,答案选A。
本题难度:一般
3、填空题 (14分)根据下图所示装置回答问题:

(1)装置A中a电极的电极反应式为 ,b电极的电极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为19.2g时,a极上消耗O2在标准状况下的体积为 L。
(4)当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。(溶液体积为100mL不变)
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
参考答案:⑴O2+4e-+2H2O = 4OH- 2H2-4e-+4OH-= 4H2O
⑵阳(1分) 4OH--4e-= 2H2O+O2↑ ⑶3.36L ⑷0 ⑸阳(1分) Cu2++2e-=Cu
本题解析:装置A为以氢氧化钾为电解质溶液的氢氧燃料电池,a为正极、b为负极;B为电解池,铁电极为阴极、C为阳极;(1)装置A中a为正极,电极的电极反应式为O2+4e-+2H2O = 4OH-,b为负极,电极的电极反应式为2H2-4e-+4OH-= 4H2O;(2)装置B中C为阳极,电极反应为4OH--4e-= 2H2O+O2↑;(3)铁为阴极,电极反应为Cu2++2e-= 2Cu,生成0.3mol铜转移电子0.6mol,a极上消耗O2 0.15mol,在标准状况下的体积为3.36L L;(4)当装置A中消耗0.05mol氢气时,转移电子0.1mol,装置B中生成氢离子0.1mol,氢离子浓度为1 mol/L,溶液的pH为0;(5)电解精炼铜,则粗铜作阳极极,另一极为精铜,反应为Cu2++2e-=Cu。
考点:本题考查电化学原理。
本题难度:困难
4、选择题 下列各装置中铜电极上能产生气泡的是(? )。
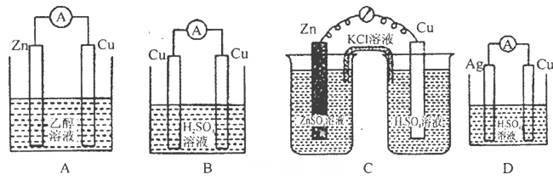
参考答案:C
本题解析:A、,溶液不是电解质溶液,不能形成原电池,错误;B、两极材料相同,不能形成原电池,铜上无气泡,错误;C、原电池装置,铜作正极,H+放电成为氢气,正确;D、不能构成原电池,不存在氧化还原反应,错误,答案选C。
本题难度:简单
5、选择题 以葡萄糖为燃料可以形成微生物燃料电池(酸性电解质体系中)。关于该电池的叙述正确的是
[?]
A.该电池能够在高温下工作
B.电池的负极反应为:?C6H12O6+6H2O?-?24e-=?6CO2↑+24H+?
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上生成标准状况下CO2气体(22.4/6)L
参考答案:B
本题解析:
本题难度:一般