| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡》练习题(十)
参考答案:C 本题解析:A.可逆反应是指在相同条件下,既能向正反应方向进行,又能够向逆反应方向进行的反应,错误;B.错误;C.反应不能进行彻底,各物质共存,正确,D错误;选C。 本题难度:一般 2、选择题 下列实验事实不能用平衡移动原理解释的是( )。 |
参考答案:D
本题解析:A项,水的电离是可逆过程,升高温度Kw增大,促进水的电离,正确;B项,存在平衡2NO2 N2O4,升高温度平衡向生成NO2方向移动,正确;C项,氨水中存在电离平衡,浓度越稀,电离程度越大,但离子浓度降低,c(OH-)越小,pH越小,正确。D项,对可逆反应2HI(g)
N2O4,升高温度平衡向生成NO2方向移动,正确;C项,氨水中存在电离平衡,浓度越稀,电离程度越大,但离子浓度降低,c(OH-)越小,pH越小,正确。D项,对可逆反应2HI(g) H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深。
H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深。
本题难度:一般
3、填空题 (5分)在固定容积的密闭容器中,有可逆反应nA(g)+mB(g)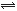 pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
参考答案:减小;不变;减小;不变;增大
本题解析: 由于该反应的正反应是吸热反应,所以根据平衡移动原理:升高温度,平衡向正反应方向移动,c(B)减小,c(C)增大,所以c(B)/c(C)减小;因为反应前后气体的质量不变,容器的容积也不变,所以混合气体的密度不变;降温时,平衡向放热反应方向移动,即向逆反应方向移动,由于该反应的正反应是气体体积减小的反应,所以平衡逆向移动,气体的物质的量增大,而气体的质量不变,所以混合气体的平均相对分子质量减小;加入催化剂,平衡不发生移动,气体的总物质的量不变;充入C,会发生反应产生A、B两种物质,则A、B的物质的量增大;
考点:考查外界条件对混合气体的密度、平均相对分子质量、物质的量等的影响的知识。
本题难度:一般
4、选择题 反应:A(g)+3B(g)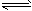 2C(g);△H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
2C(g);△H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是
[? ]
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
D.正反应速率和逆反应速率变小,平衡向逆反应方向移动
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)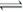 Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.2v正(X)=v逆(Y)
B.单位时间内生成1 mol Y的同时生成2 mol X
C.混合气体的密度不再变化
D.反应容器中Y的质量分数不变
参考答案:A
本题解析:A、反应在任何时刻都有2v正(X)=v逆(Y),不能判断反应达到化学平衡状态,错误;B、单位时间内生成1 mol Y代表正反应速率,同时生成2 mol X,代表逆反应速率,且符合化学计量数之比,可以说明化学反应达到平衡状态,正确;C、容器的体积不变,但是该反应有固体参与,所以气体的质量分数变化,达到平衡时,气体的质量不再变化,则气体的密度不再变化,正确;D、达到平衡时容器中各物质的质量分数都保持不变,可以判断化学反应达到平衡状态,正确,答案选A。
考点:考查化学平衡状态的判断
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《氧化还原、.. | |