1、选择题 某一新元素的质量数272,核内质子数是111,则其核内的中子数为
A.161
B.111
C.272
D.433
2、选择题 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
[? ]
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
3、选择题 下列对递变规律的描述正确的是
A.还原性:Na>K>Rb>Cs
B.卤素氢化物的稳定性随核电荷数的递增依次增强
C.碱金属单质的熔沸点都是随着核电荷数的增加而降低
D.卤素单质的氧化性都是随着核电荷数的增加而增强
4、推断题 已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题。
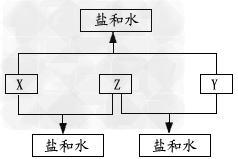
(1)D元素原子的结构示意图为_______________;
(2)A、B、C三种元素的原子半径由小到大的顺序为_______________(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为?______________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈________(填“酸”、“碱”或“中”)性;
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是_______________(用化学方程式表示)。
5、选择题 元素周期律和元素周期表,揭示了元素之间的内在联系,反映了元素性质与其原子结构的关系,在哲学、自然科学、生产实践各方面都有重要的意义.例如人们可以根据元素周期律,在元素周期表中金属元素与非金属元素分界线附近寻找
A.耐高温的合金材料
B.制农药的元素
C.作催化剂的元素
D.作半导体材料的元素