1、选择题 下列设备工作时,将化学能转化为热能的是( )
A.A
B.B
C.C
D.D
参考答案:A.硅太阳能电池是太阳能转化为电能,故A错误;
B.锂离子电池是把化学能转化为电能,故B错误;
C.太阳能集热器是把太阳能转化为热能,故C错误;
D.燃烧是放热反应,是化学能转化为热能,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量.下列说法中错误的是( )
A.该反应中肼作还原剂
B.液态肼的燃烧热为20.05kJ?mol-1
C.该动力源的突出优点之一是生成物对环境污染小
D.肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6kJ?mol-1
参考答案:A、N2H4中N元素为-2价,反应后生成N2为0价,所以N元素化合价升高,所以肼作还原剂,故A正确;
B、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05=641.60(kJ),但该数值不是肼的燃烧热,故B错误.
C、液态肼和液态过氧化氢反应生成氮气和水蒸气,对环境物污染,故C正确;
D、1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05=641.60(kJ)所以肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 kJ?mol-1,故D正确.
故选:B.
本题解析:
本题难度:简单
3、选择题 下列原理所测的中和热最接近-57.3 kJ/mol的是(?)
A.将标况下11.2L HCl气体通入50mL 0.01 mol/L NaOH溶液中反应
B.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L HNO3溶液反应
C.用55mL 0.01 mol/L Ba(OH)2溶液与50mL 0.01 mol/L H2SO4溶液反应
D.用55mL 0.01 mol/L NaOH溶液与50mL 0.01 mol/L HF溶液反应
参考答案:B
本题解析:A、稀HCl和稀NaOH反应生成的水的物质的量不一定是1mol,放出的热量不一定为57.3kJ,故A错误;B、生成的水的物质的量是1mol,放出的热量为57.3kJ,故B正确;C、生成的水的物质的量为1mol,且有硫酸钡沉淀生成,放出的热量比57.3kJ多,故C错误.D、氢氟酸是弱酸电离时会吸收热量,放出的热量较少,错误;故选:B。
本题难度:一般
4、选择题 下列有关化学反应热的描述中,正确的是?(?)
①化学反应过程中一定有能量变化;②△H>0表示放热反应,△H<0表示吸热反应;③△H的大小与热化学方程式中的化学计算数成正比;④放热反应在常温下就一定能进行;⑤生成物的总能量小于反应物总能量时,△H<0;⑥化学反应中放出的热才是反应热;
A.①③⑤
B.②④⑥
C.①②③
D.④⑤⑥
参考答案:A
本题解析:化学变化的特征之一就是伴随能量的变化。△H>0表示吸热反应,△H<0表示放热反应。在热化学方程式中物质前面的化学计量数表示的是参加反应的物质的物质的量,与反应热成正比。反应条件与反应是放热反应还是吸热反应无关。生成物的总能量小于反应物的总能量,反应是放热反应,△H<0。在化学反应过程中放出或吸收的能量都是反应热。答案是A。
本题难度:一般
5、填空题 (15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)  ?Ni(CO)4(g),
?Ni(CO)4(g),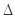 H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是??
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是??
(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,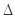 H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
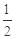 O2(g)==CO(g)?
O2(g)==CO(g)?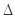 H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1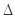 H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1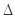 H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1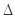 H=?kJ·mol-1。
H=?kJ·mol-1。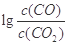 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。