1、填空题 海水中富含氯元素。
(1)KCl广泛应用于医药和农业,KCl晶体中基态的氯离子电子排布式为?
(2)下列是部分金属元素的电离能
?
| X
| Y
| Z
|
第一电离能(KJ/mol)
| 520.2
| 495.8
| 418.8
|
已知X Y Z 的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为?
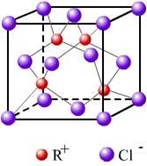
(3)RCl用作有机机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是?,与同一个Cl-相连的 R+有?个。
(4) 卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3—CH2—Cl和碱溶液容易发生取代反应,而CH2=CH2—Cl 和碱溶液不起作用,请从结构上解释其差异?
(5) HCl和 HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异?
参考答案:(1)1s22s22p63s23p6 ?(2)ZCl<Ycl<XCl (3) Cu? 4?
(4)? CH3—CH2—Cl中与Cl原子成键的C以sp3杂化,而CH2=CH2—Cl中与Cl原子成键的C以sp2杂化,电子云密度不同;CH3—CH2—Cl中的C—Cl的键长比CH2=CH2—Cl中C—Cl要长;CH2=CH2—Cl的∏键对Cl的作用力比CH3—CH2—Cl的a键强。?
(5)HF沸点比HCl高;氢氟酸是弱酸,盐酸是强酸;实验测得HF分子质量偏大。
本题解析:本题考查物质结构与性质。主要考查点是电子排布式的书写、杂化轨道的基础知识、晶体的结构分析、电离能等。(2)已知X Y Z 的价层电子构型为nS1,说明三者在同一个主族,第一电离能逐渐减小,金属性逐渐增强,则原子半径逐渐增大,熔沸点逐渐减小;(3)R+中所有电子正好充满K、L、M 三个电子层,说明R的电子排布式为:1s22s22p63s23p63d10,是铜元素,从图中看出,一个R+有有4个Cl-相连,同理与同一个Cl-相连的 R+有4个;(4)CH3—CH2—Cl中与Cl原子成键的C以sp3杂化,而CH2=CH2—Cl中与Cl原子成键的C以sp2杂化,电子云密度不同;CH3—CH2—Cl中的C—Cl的键长比CH2=CH2—Cl中C—Cl要长;CH2=CH2—Cl的∏键对Cl的作用力比CH3—CH2—Cl的a键强;(5)氢键影响物质的物理性质。
本题难度:一般
2、选择题 四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z—离子的电子数之差为8。下列说法不正确的是
A.与W想邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4
D.X的单质在W的最高价氧化物中的燃烧反应属于置换反应
参考答案:C
本题解析:
答案:C
C.不正确,W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2ZO4
Z的非金属性强,最高价氧化物对应的水化物中酸性最强。
本题难度:一般
3、选择题 硼有两种天然同位素105B和115B,硼元素的近似相对原子质量为10.80,则对115B的原子百分比是(?)
A .80﹪? B.20﹪? C. .40﹪? D无法计算
参考答案:A
本题解析:根据M=M1*n1%+M2*n2%+……,假设115B的原子百分比是x,则105B百分比是(1-x),根据公式可以得到10*(1-x)+11x=10.80,得到x=0.8,故115B的原子百分比是80%。
本题难度:一般
4、选择题 几种短周期元素的原子半径及主要化合价如下表
元素代号
| L
| M
| X
| R
| T
|
原子半径(nm)
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6、-2
| +2
| -2
|
?
下列说法正确的是
A.L、T形成的简单离子核外电子数相等
B.R的氧化物对应的水化物呈强碱性
C.X单质在氧气中燃烧生成XO3
D.离子半径大小:r(M3+)> r(T2-)
参考答案:A
本题解析:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于R小于L可知应和L同周期,为Al元素,则A、Mg2+核外有2个电子层,O2-核外有2个电子层,二者电子层结构相同,故A正确;B、R为Be,与Al位于周期表对角线位置,性质相似,Al的氧化物的水化物为两性氢氧化物,则Be的氧化物对应的水化物可能具有两性,故B不正确;C、S在空气中燃烧只生成SO2,二氧化硫与氧气在催化剂的条件下反应生成SO3,故C不正确;D、Al3+和O2-具有相同的核外电子排布,原子序数越大,半径越小,则离子半径大小:r(Al3+)<r(O2-),故D错误,故选A。
本题难度:一般
5、填空题 (6分)如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
(1)写出元素符号:A_________;B______;C_________。
(2)C的原子结构示意图:____;B的最高价氧化物对应水化物的化学式为_______。
(3)A的氢化物的水溶液显____(填酸或碱)性。
参考答案:(6分)(1)A :N;B:S;C:F (2)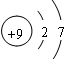 ; H2SO4(3)碱性
; H2SO4(3)碱性
本题解析:根据元素在周期表中的位置可知,设A的原子序数为a,则C是a+2,B是a+9.所以a+a+2=a+9,解得a=7,即ABC分别是N、S、F。氟元素位于周期表的第二周期第ⅦA族,其结构示意图为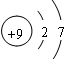 。硫的最高价是+6价,最高价氧化物的水化物的化学式为H2SO4。氨气溶于水生成一水合氨,显碱性。
。硫的最高价是+6价,最高价氧化物的水化物的化学式为H2SO4。氨气溶于水生成一水合氨,显碱性。
本题难度:一般