1、填空题 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol /L的稀H2SO4 500 mL的操作,请按要求填空:
/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)如果实验室有15mL.20mL.50mL量筒,应选用_____mL量筒最好。量取时发现量 筒不干净,用水洗净后直接量取,所配溶液浓度将________(偏高、偏低、无影响)。
筒不干净,用水洗净后直接量取,所配溶液浓度将________(偏高、偏低、无影响)。
(2)将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100mL水的_______里,并不断搅拌,目的是________________________________。
(3)将___________________________的上述溶液沿___________注入______________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要? ________________中,并摇匀。
(4)加水至距刻度线___________处,改用____________加水,使溶液的凹液面正好跟刻度相平。
参考答案:(1)15?偏低?(2)烧杯?混合均匀,使热量迅速扩散
(3)冷却至室温?玻璃棒? 500mL容量瓶?转移到容量瓶
(4)1~2cm?胶头滴管
本题解析:略
本题难度:简单
2、选择题 下列试剂贮存方法正确的是
A.氢氟酸用玻璃瓶密封贮存
B.NaOH溶液用磨口玻璃瓶加玻璃塞封存
C.水玻璃用塑料桶敞口放置
D.纯碱溶液可用带橡胶塞的玻璃瓶封存
参考答案:D
本题解析:氢氟酸能腐蚀玻璃,A不正确;氢氧化钠溶液能和二氧化硅反应生成粘性很强的硅酸钠,是玻璃塞和瓶口粘合在一起,不易打开,B不正确;水玻璃易吸收空气中的CO2,生成硅酸沉淀而本质,因此不能敞口放置,C不正确,所以答案选D。
点评:试剂保存的原则还是依据试剂的性质进行选择的,所以该题的关键是仍然是熟练记住常见化学试剂的性质,包括物理性质和化学性质等。
本题难度:简单
3、选择题 下列实验操作中,正确的是?
A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B.蒸馏操作时,应将温度计插入烧瓶中的溶液中
C.测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
参考答案:A
本题解析:蒸馏操作时,应将温度计插入烧瓶的支管出口处,B不正确。C不正确,应该用玻璃棒蘸取待测液点在试纸上。分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体从上口倒出,D不正确,因此正确的答案选A。
本题难度:简单
4、选择题 在实验室中,对下列事故或药品的处理正确的是
A.有大量的氯气泄漏时,用肥皂水浸湿软布捂住鼻孔,并迅速离开现场
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.含硫酸的废液倒入水槽,用水冲入下水道
参考答案:A
本题解析:A、氯气有毒,属于酸性气体,能和弱碱性的肥皂水反应,故A正确;
B、金属钠能和二氧化碳发生反应,不能用泡沫灭火器灭火,一般用沙土覆盖,故B错误;
C、少量浓硫酸沾在皮肤上,立即用布擦去,再用大量的水冲洗,故C错误;
D、不能将废液随便倾倒,要放在回收桶中,集中处理,故D错误.
故选A.
本题难度:简单
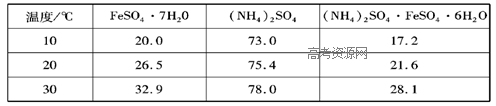
5、实验题 硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
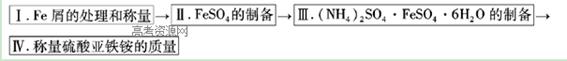
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是?,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
参考答案:(1)洗涤铁屑表面的油污(1分)?(3) 3.13 (m1-m2)(2分)?
无水乙醇 (1分)?(4) 98%(3分)
本题解析:(1)热的Na2CO3溶液因为水解程度较大,碱性较强,能促进油污的水解而除去。
(3)第(2)步参加反应的铁的质量为(m1-m2)g,物质的量为(m1-m2)/56mol,则生成FeSO4的物质的量为(m1-m2)/56mol,由化学式(NH4)2S O4?FeSO4?6H2O可知,需要(NH4)2SO4的物质的量为(m1-m2)/56mol,设配成饱和溶液需水的质量为mg,根据20℃(NH4)2SO4的溶解度为75.4g列出计算式:?(m1-m2)/56mol×132g/mol:mg=75.4g:100g,解得m=3.13(m1-m2)g;因为硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗,过滤后用无水乙醇洗涤晶体。
(4)根据氧化还原反应电子得失相等可得对应关系:KMnO4—5Fe2+,样品中的(NH4)2SO4·FeSO4·6H2O的质量分数为:0.01mol/L×o.1L×5×4×392g/mol÷1.6g×100%=98%。
本题难度:一般