1、实验题 (9分)在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
①V(NaOH)(mL)
| 0.00
| 18.00
| 19.80
| 19.96
| 19.98
| 20.00
| 20.02
| 20.04
| 20.20
|
②溶液的pH
| 1.0
| 2.3
| 3.3
| ?
| 4.3
| 7
| 9.7
| ?
| 10.7
|
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
参考答案:(共9分)
(1)4.0?(1分)? 10.0?(1分)
(2)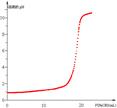 (2分)?滴定终点附近溶液的pH变化特别大(1分)
(2分)?滴定终点附近溶液的pH变化特别大(1分)
(3)误差≤0.1%,即要求滴定终点时所加体积范围是19.98 mL~20.02 mL之间,根据表中数据可知此时溶液的pH范围在4.3~9.7之间,其最小值4.3在甲基橙的变色范围(3.1~4.4)以内,所以能用甲基橙作该中和滴定的指示剂。(2分)
(4)小?(1分)?难?(1分)
本题解析:略
本题难度:一般
2、选择题 下列有关实验的叙述正确的是( )
A.可用碱式滴定管量取12. 85 mL的KMnO4溶液
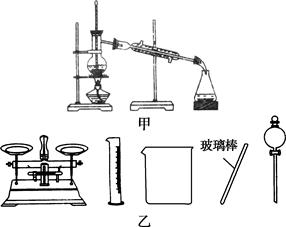
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制500 mL 0.4 mol·L-1NaCl溶液,必要的仪器如图乙所示
参考答案:C
本题解析:A中KMnO4溶液具有强氧化性,不能用碱式滴定管量取;B中的温度计水银球反应位于蒸馏烧瓶支管口处; D中不需要分液漏斗,而需要容量瓶。
本题难度:一般
3、选择题 要清去镜子背面的银镀层,最好选用的试剂是( )
A.稀盐酸
B.稀硝酸
C.浓盐酸
D.稀硫酸
参考答案:金属的活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,金属性由强到弱.排在氢前面的金属可与盐酸和硫酸反应,银排在氢的后面,所以与稀盐酸、浓盐酸、稀硫酸均不反应,而稀HNO3可与银反应,3Ag+4HNO3═3AgNO3+NO↑+2H2O,实际操作灵活简单,所以最好选用的试剂可用稀HNO3清洗做过银镜反应的试管,所以B正确,
故选B.
本题解析:
本题难度:简单
4、选择题 下列储存药品的方法中,正确的是
A.浓硫酸保存在橡胶塞试剂瓶中
B.浓硝酸保存在无色试剂瓶中
C.金属钠保存在煤油中
D.氢氧化钠溶液保存在玻璃塞试剂瓶中
参考答案:C
本题解析:浓硫酸具有脱水性、强氧化性,不能用橡皮塞;浓硝酸保存在棕色试剂瓶中,因它具有不稳定性,见光会分解;金属钠与氧气和水能反应,应保存在煤油中;氢氧化钠溶液保存不能用玻璃塞。答案选C。
本题难度:一般
5、选择题 将固体MnC2O4·2H2O放在坩埚里加热,固体质量随温度变化的数据如下表:
温度(℃)
| 25
| 50
| 75
| 100
| 214
| 280
|
固体质量(g)
| 17.9
| 17.9
| 16.0
| 14.3
| 14.3
| 7.10[
|
下列说法错误的是
A.25~50 ℃,MnC2O4·2H2O未发生变化
B.75 ℃时,MnC2O4·2H2O部分失去结晶水
C.100℃时,坩埚内固体均为MnC2O4
D.280℃时,坩埚内固体为混合物
参考答案:D
本题解析:由MnC2O4·2H2O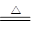 MnC2O4+2H2O
MnC2O4+2H2O
可知:? 17.9? 14.3
当晶体推动全部结晶水后所得MnC2O4的质量为14.3g,故A、B、C所述正确
根据表格数据,结合锰的氧化物的式量,可得到:如果MnC2O4全部转变以MnO,则恰好质量为7.1g,故可判断在280℃时,MnC2O4全部转变为MnO,故D描述错误。
本题难度:一般