| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《反应速率与平衡的有关计算》考点预测(2019年强化版)(二)
 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。 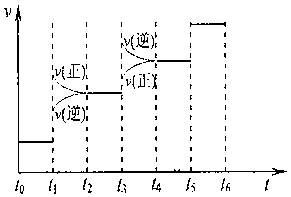 ? ?图t1时引起平衡移动的条件可能是?。 其中表示平衡混合物中NH3含量最高的一段时间是?。 ②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为?。 参考答案:(12分)(1)保护臭氧层 本题解析:略 本题难度:简单 3、选择题 在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)
A.上述生成Ni(CO)4(g)的反应为吸热反应 B.25℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为0.5 Ni(s)+4CO(g)的平衡常数为0.5C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆) D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L 参考答案:D 本题解析: 本题难度:一般 4、选择题 在一定温度,固定体积的密闭容器中,下列叙述不是可逆反应A(g)+3B(g)? 参考答案:A 本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以①③正确。②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不正确。该反应是体积减小的可逆反应,即压强和物质的量也是减小的,所以当压强和物质的量不再发生变化时,可以说明,④⑥正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,⑤不正确。⑦中反应速率的方向相反,且能满足速率之比是相应的化学计量数之比,⑦正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,⑧不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以⑨可以说明,答案选A。 本题难度:简单 5、选择题 下列关于物质“反应程度”的说法正确的是(?) 参考答案:D 本题解析:因为SO2与O2的反应、N2与H2的反应都是可逆反应,反应物不可能完全转化为生成物,故A不正确,D正确;MnO2只能与浓盐酸反应制取Cl2,含4mol HCl的浓盐酸与足量MnO2反应产生的Cl2将少于1mol,B也不正确。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《吸热反应与.. | |