1、填空题 SO2随意排放会造成严重的大气污染.下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法.
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
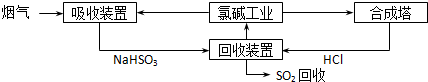
①“吸收装置”中发生反应的离子方程式是______;
②合成塔中每合成1mol?气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是______;
③上述流程中循环利用的物质是______.
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是______(反应a).为验证该反应,同学们将SO2通入0.05mol?L-1?FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.
| 分析推测 | 实验步骤
甲:生成了Fe(OH)3胶体
乙:经查阅资料,可能发生反应:
Fe3++6SO2
Fe(SO2)(反应b)
ⅰ.制备Fe(OH)3胶体并检验
ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色
|
②利用胶体的______(填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体;
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是______(用离子方程式及必要的文字说明);
④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是______.
参考答案:(1)①氯碱工业产品之一为NaOH,用NaOH吸收SO2,其离子方程式为:SO2+OH-=HSO3-,
②已知每合成1mol HCl放出热量92.3kJ,故其热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1;
③回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液;
故答案为:①SO2+OH-=HSO3-;②H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1;③NaCl溶液;
(2)①利用FeCl3溶液的氧化性吸收烟气中的SO2,SO2在溶液中被氧化为SO42-,同时Fe3+被还原为Fe2+;故方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
②丁达尔效应是检验胶体的常用方法;
③Fe3+能被铁粉还原为Fe2+,2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动;
④溶液很快由黄色变为红褐色,说明b的化学反应速率快;最终变为浅绿色,说明最终生成Fe2+,即a进行的程度大,由此可知由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象;
故答案为:①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+②丁达尔效应③加入铁粉时发生反应2Fe3++Fe=3Fe2+,c(Fe3+)减小,使反应b逆向移动④由于化学反应速率:b>a,化学反应限度:a>b,所以产生上述现象.
本题解析:
本题难度:一般
2、选择题 下列叙述合理的是( )
A.构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质完全相同
B.金属材料都是导体,非金属材料都是绝缘体
C.我国规定商家不得无偿提供塑料袋,目的是减少“白色污染”
D.煤的脱硫主要作用是防止酸雨加剧和光化学烟雾的形成
参考答案:C
本题解析:
本题难度:简单
3、简答题 我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示
浓度限值(mg/m3)
一级标准
二级标准
三级标准
0.15
0.50
0.70
|
现有某化学兴趣小组按如图所示的实验装置对某地空气中二氧化硫含量进行测定:向试管中加入1.00mL1.00×10-3mol?L-1碘水,加入适量水,再加入2~3滴淀粉溶液使溶液显蓝色,通过抽气装置缓慢抽气,使空气由导气管进入试管与碘水充分反应,当溶液由蓝色变为无色时,恰好完全反应(反应的化学方程式:S02+I2+2H20=H2SO4+2HI),实验过程中进入试管内的空气的总体积为0.1m3.请计算此空气中二氧化硫的浓度为多少mg/m3,并判断二氧化硫的浓度级别为几级.

参考答案:100L=0.1m3
设0.1m3空气中含SO2质量为x
S02+I2+2H20═H2SO4+2HI
64 1mol
x 1.00×10-3L×1.00×10-3mol?L-1
x=1.00×10-3L×1.00×10-3mol/L×64g/mol1mol=0.064mg
则空气中SO2浓度=0.064mg÷0.1m3=0.64mg/m3,由于0.50mg/m3<0.64mg/m3<0.70mg/m3,此空气中二氧化硫的浓度为三级,
答:空气中二氧化硫的浓度为0.64mg/m3,二氧化硫的浓度级别为三级.
本题解析:
本题难度:一般
4、选择题 酸雨形成的主要原因是( )
A.汽车排出大量尾气
B.自然界中硫化物分解
C.工业上大量燃烧含硫燃料
D.可燃冰燃烧
参考答案:C
本题解析:
本题难度:简单
5、选择题 二氧化硫是污染大气并形成酸雨的主要有害物质之一.造成大气中二氧化硫含量急剧增加的最主要原因是( ? )
A.硫酸厂排放出的废气中的二氧化硫
B.由火山爆发产生的二氧化硫
C.由实验室逸出的二氧化硫
D.由煤和石油燃烧产生的二氧化硫
参考答案:D
本题解析:
本题难度:简单