1、选择题 下列描述中,符合化学科学的是
[? ]
A.“纯碱”就是碱
B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C.“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D.“曾青得铁则化为铜”中的“曾青”是指青铜
参考答案:B
本题解析:
本题难度:简单
2、实验题 某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色。”
【资料】
| 溴水是溴单质的水溶液,因溶有溴单质而呈黄色。
|
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①?(填离子方程式)所致。
溶液呈黄色是因发生离子反应②?(填离子方程式)所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂
| 酚酞试液、CCl4、无水酒精、KSCN溶液
|
方案
| 操作步骤
| 实验现象
| 结论
|
1
| 取所述黄色溶液于试管中,滴加?并振荡
| 溶液变红色
| 反应?所致
|
2
| 取所述黄色溶液于试管中,滴加?并振荡
| ________
________
|
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-?(填“强”或“弱”)。
(4)实验反思
I. 根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是?。
Ⅱ. 在100 mLFeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?。
参考答案:(1)2Fe2++Cl2=2Fe3++2Cl-;2Br-+Cl2=Br2+2Cl-
(2)
方案
操作步骤
实验现象
结论
1
KSCN溶液
?
①
2
CCl4
溶液分上下两层,上层为黄色、下层为无色
本题解析:(1)因为单质溴和铁离子在溶液中均显黄色,氯气既能氧化亚铁离子生成铁离子,还能氧化溴离子生成单质溴。所以反应的离子方程式分别为2Fe2++Cl2=2Fe3++2Cl-、2Br-+Cl2=Br2+2Cl-。
(2)如果反应中生成铁离子,则加入KSCN溶液,溶液应该显红色。如果生成的是单质溴,则可以利用萃取进行验证。
(3)亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。
(4)如果氯水足量,则溴离子也被氧化生成单质溴。如果加入CCl4并充分振荡后静止,溶液应分上下两层,上层为黄色、下层为橙红色。如果FeBr2的物质的量是xmol,则根据得失电子守恒可知x×1+2x×1/2×1=0.1×2,解得x=0.1,所以浓度是1mol/L。
本题难度:一般
3、实验题 (12分)温度对化学反应速率影响的实验探究根据下图所给出的仪器和药品进行实验。

操作方法:在三支相同的试管中分别加入2 mL—3 mL约5%的H2O2,然后在每支试管中滴加2滴1 mol·L-1的FeCl3溶液后立即套上气球(大小相同)。等三支试管上的气球大小差不多相同时,同时置于三个烧杯中观察现象。
实验现象为___________________________________________________________________。
实验结论为___________________________________________________________________。
参考答案:气球膨胀的由快到慢的顺序为左→中→右
升高温度加快反应速率,降低温度减慢反应速率
本题解析:H2O2在不同温度下的分解速率不同,很明显,温度越高,反应速率越快,FeCl3在此作催化剂。
本题难度:简单
4、实验题 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
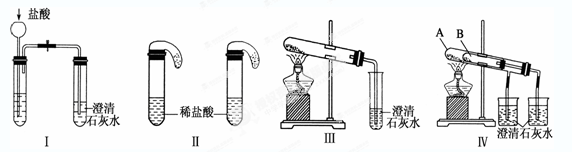
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)___?_______;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都发生的反应的化学方程式为_____________?___________;与实验Ⅲ相比,实验Ⅳ的优点是__________________________;
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________;
(4)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是_____________(填“正确”或“错误”)的。
(5)将碳酸氢钠溶液与足量的澄清石灰水混合并充分反应,其离子方程式为_________________________。其剩余溶液的溶质化学式为___________
(6)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
①________________________________________________________________________;
②_______________________________________________________________________。
参考答案:(1)Ⅱ(2)2NaHCO3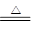 Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行(3)2NaHCO3(4)错误(5)HCO3-+Ca2++OH-=CaCO3↓+H2O ;Ca(OH)2、NaOH
Na2CO3+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行(3)2NaHCO3(4)错误(5)HCO3-+Ca2++OH-=CaCO3↓+H2O ;Ca(OH)2、NaOH
(6)①焰色反应,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是2NaHCO3。
②加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是2NaHCO3。
本题解析:(1)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠。
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,反应的化学方程式是2NaHCO3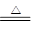 Na2CO3+H2O+CO2↑。CO2能使澄清的石灰水变混浊,则反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O。与实验相比,实验Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行。
Na2CO3+H2O+CO2↑。CO2能使澄清的石灰水变混浊,则反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O。与实验相比,实验Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行。
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠。
(4)澄清石灰水均能和碳酸氢钠以及碳酸钠反应生成白色沉淀碳酸钙,不能鉴别,所以这种说法是错误的。
(5)如果澄清的石灰水过量,则碳酸氢钠和石灰水反应生成物是碳酸钙、氢氧化钠和水,反应的离子方程式是HCO3-+Ca2++OH-=CaCO3↓+H2O。因此剩余溶液的溶质化学式为Ca(OH)2、NaOH。
(6)①根据盐中阳离子的不同,可以通过焰色反应鉴别,即利用焰色反应,隔蓝色钴玻璃观察,能看到紫色焰色的是K2CO3,否则是2NaHCO3。
②根据盐中阴离子的不同,可以利用沉淀法鉴别。即加入BaCl2(CaCl2)溶液,产生白色沉淀的是K2CO3,否则是2NaHCO3。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。明确物质的性质和实验原理,是答题的关键。
本题难度:一般
5、实验题 (18分)科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性。
(一)学生(甲)应用下图装置(A)所示意的方法研究氯气的性质,其中气体的主要成分是氯气(含有空气和水蒸气)。请回答下列问题:

(1)该项研究(实验)的主要目的是?
(2)浓硫酸的作用是?。与研究目的直接相关的实验现象是? ________________? _?。
(3)虚框中的装置应选择??(填“B”或“C”),其盛放的试剂
为??(填试剂名称);使用该装置的目的是?;该装置内发生反应的化学方程式为??。
(二)学生(乙)设计实验探究金属铝表面氧化膜的性质:将铝片(含氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。回答下列问题:
(1)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是?。
(2)同学(乙)认为:铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因是“氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能”。并设计如下实验方案进行验证,请你根据其思路完成下列空格:
[实验方案] 在硫酸铜溶液中加入铝片,无明显现象,再加入?(填试剂名称),若反应明显加快了,说明上述推断正确。
参考答案:(18分)(一)
(1)比较干燥的氯气和潮湿的氯气的漂白性(或研究氯气的漂白性实验等合理答案均可)(2分)
(2)吸收气体中的水;干燥的有色布条不褪色,湿润的有色布条褪色(合理答案均可)
(各空2分,共4分)
(3)B?;NaOH溶液;防止有毒的Cl2污染空气;2NaOH + Cl2 ="=" NaCl + NaClO+ H2O (各空2分,共8分)
(二)(1)2Al+3Cu2+=3Cu+2Al3+;(2分)
(2)氯化钠(加入盐酸错误)(2分)
本题解析:通过实验设计与探究,研究反应原理及物质的性质
(一)(1)混有水蒸汽的氯气,先通过浓硫酸,得到干燥的氯气;随后氯气分别与干燥、湿润的有色面条接触,很明显是对比实验,比较干燥的、潮湿的氯气的漂白性差异
(2)浓硫酸吸收气体中的水,必然导致干燥的有色面条无变化,但与湿润的有色布条可生成次氯酸,最终导致其褪色
(3)由于氯气有毒,不能直接排放到空气中,而C装置是个密封装置,不正确,故应选择B装置:氯气可被碱液吸收2NaOH + Cl2 ="=" NaCl + NaClO+ H2O
(二)(1)红色物质必须是铝置换出的铜单质:2Al+3Cu2+=3Cu+2Al3+
(2)实验中两盐溶液溶质的差别无所谓就是阴离子的不同,导致了反应现象的不同,故可在硫酸铜溶液中加入铝片,无明显现象后,再加入含有氯离子溶液即可,为了不改变溶液的酸碱性,最好加入氯化钠溶液,再观察现象
本题难度:一般