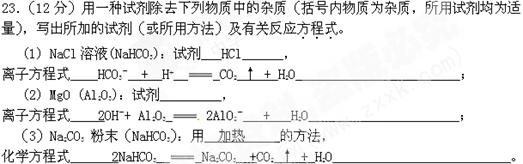
1、填空题 (12分)用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂(或所用方法)及有关反应方程式。
(1) N aCl溶液(NaHCO3):试剂?,离子方程式?;
aCl溶液(NaHCO3):试剂?,离子方程式?;
(2) MgO (Al2O3):试剂?,离子方程式?;
(3)Na2CO3粉末(NaHCO3):用?的方法,化学方程式?。
参考答案:
本题解析:略
本题难度:一般
2、选择题 下列的分离方法正确的是( )
A.萃取、分液前不需对分液漏斗检漏
B.用过滤的方法除去NaCl溶液中含有的少量淀粉
C.用酒精萃取碘水中的碘
D.用蒸馏的方法除去水中的不挥发的杂质
参考答案:D
本题解析:
本题难度:简单
3、实验题 漂白粉是一种常用的消毒剂。
(1)工业上生产漂白粉反应的化学方程式为:________________?__,漂白粉的有效成分为?。
(2)某探究小组从市场上购买了一袋包装破损的漂白粉,对该漂白粉的成分进行探究。根据下列试剂,设计实验方案,进行实验。请在答题卡上完成实验报告。
限选试剂:2mol·L-1NaOH溶液、2mol·L-1HCl溶液、2mol·L-1HNO3溶液、0.5mol·L-1BaCl2溶液、0.01mol·L-1AgNO3溶液、澄清石灰水、石蕊试液、酚酞试液、蒸馏水。
实验步骤
| 预期现象与结论
|
步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液。
| ?
|
步骤2:向沉淀加入适量2mol·L-1HCl溶液,将产生的气体通入?
?
| 现象:?
?
结论:?
|
步骤3:取滤液分装A、B两支试管。向A试管,?
?
| 现象:溶液先变红色,然后褪色。
结论:?
?
|
步骤4:向B试管,?
??
| 现象:产生白色沉淀。
结论:?
|
?
(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00mL。则该漂白粉中Ca(ClO)2的质量分数为_____________?_。(只列算式,不做运算,已知:Mr[Ca(ClO)2]="143" ;Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
参考答案:(17分)
(1)2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O?(3分)? Ca(ClO)2(1分)
(2)
实验步骤
预期现象与结论
?
步骤2:适量澄清石灰水(1分)
现象:沉淀溶解(1分),产生的气体使石灰水变浑浊(产生沉淀),或石灰水先产生白色沉淀,后沉淀溶解)(1分)
结论:该漂白粉含有CaCO3。(1分)
?
步骤3:滴加2滴酚酞试液(1分)
结论:该漂白粉含有Ca(ClO)2,(1分)
可能含有Ca(OH)2。(1分)
步骤4:滴加过量2mol·L-1HNO3溶液(1分)和0.01mol·L-1AgNO3溶液(1分)
?
结论:该漂白粉含有CaCl2。(1分)
?
(说明:1、试剂用量不准确,整题合扣1分;? 2、其他合理即给分)
(3)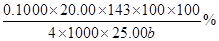 ?或
?或 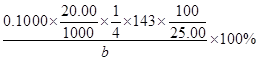
或 (3分,有效数字不准确,扣1分)
(3分,有效数字不准确,扣1分)
本题解析:(1)工业上用氯气和足量氢氧化钙反应制漂白粉,即2Ca(OH)2+2Cl2=CaCl2+ Ca(ClO)2+2H2O;漂白粉的有效成分是次氯酸钙,即Ca(ClO)2;(2)步骤2:若漂白粉变质,由于碳酸的酸性比次氯酸强,则次氯酸钙与空气中的CO2、H2O能发生复分解反应,即Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,因此漂白粉溶于水后所得沉淀可能是碳酸钙;盐酸的酸性比碳酸强,若沉淀溶于足量2mol/LHCl溶液,产生的气体能使足量澄清石灰水变浑浊,或者产生的气体先使澄清石灰水变浑浊,后又变澄清,说明漂白粉已经部分变质或完全变质,其中含有CaCO3;步骤3:酚酞先遇碱性溶液变红,后遇次氯酸盐溶液褪色,根据结论推断,向A管中加入几滴或少量酚酞溶液,振荡,溶液先变红后褪色的,说明该漂白粉部分变质,含有Ca(ClO)2,可能含有Ca(OH)2;步骤4:向B管中先滴入足量2mol/LHNO3溶液、后滴入少量0.01mol/LAgNO3溶液,产生白色沉淀,说明该漂白粉中含有CaCl2;(3)由于n=c?V,则每次滴定平均消耗0.1000×20.00×10—3molNa2S2O3;由于2Na2S2O3+I2=Na2S4O6+2NaI中各物质的系数之比等于物质的量之比,则与Na2S2O3反应的I2为0.1000×20.00×10—3/2mol;由于 Cl2+2KI=2KCl+I2中各物质的系数之比等于物质的量之比,则置换出I2需要0.1000×20.00×10—3/2mol Cl2;由于Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O中各物质的系数之比等于物质的量之比,则25.00mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4mol;100mL漂白粉溶液中含有的Ca(ClO)2为0.1000×20.00×10—3/4×100/25.00mol,由于m=n?M、Mr[Ca(ClO)2]=143,则100mL漂白粉溶液中含有的0.1000×20.00×10—3/4×100/25.00×143gCa(ClO)2,则漂白粉中Ca(ClO)2的质量分数为0.1000×20.00×10—3/4×100/25.00×143/b×100%。
本题难度:困难
4、选择题 选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是
[? ]
A.不溶于水,且必须不与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密谋大
D.不溶于水,且必须比水密度小
参考答案:AB
本题解析:
本题难度:简单
5、实验题 草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸业铁晶体的化学性质,?进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有?(填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为?mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:?
假设三:?
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
实验步骤(不要求写出具体操作过程)
| 预期实验现象和结论
|
取少量黑色固体,?
?
?
| ?
?
?
|
?
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:?。

根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
?
参考答案:(共1 5分)
(1)还原性(1分) ?0.6(2分)
(2)假设二:全部是Fe3O4(1分)?假设三:是FeO和Fe3O4的混合物(1分)
(3)【定性研究】(每空2分)
实验步骤:取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液
预期实验现象和结论:若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立
【定量研究】
FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑,3分)
不同意(1分),实验未在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物(2分)
本题解析:
(1)高锰酸钾溶液的紫红色褪去,溶液变为棕黄色,很显然是FeC2O4被高锰酸钾氧化为Fe3+的结果,表明FeC2O4具有还原性。分析有关元素化合价的变化可知,反应过程中1 mol FeC2O4·2H2O可失去3 mol电子,而l mol KMnO4可得到5 mol电子:根据得失电子数相等的原则,反应中FeC2O4·2H2O与KMnO4的物质的量之比为5:3。因此,若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为3/5 mol。
(2)铁的氧化物中,呈黑色的有FeO和Fe3O4。
(3)【定性研究】FeO与盐酸或硫酸反应生成Fe2+,Fe2+与KSCN不反应。但Fe3O4或FeO和Fe3O4的混合物溶于稀盐酸或稀硫酸中生成Fe3+,遇KSCN变红色。据此即可设计方案进行验证。
【定量研究】草酸亚铁品体受热首先失去结品水,得到FeC2O4(即A点对应物质)。400℃时固体质量减少,应该是FeC2O4发生分解,牛成铁的氧化物(即B点对应物质)。根据图象可知1.0 g晶体分解生成的铁的氧化物的质量为0.4 g。设此铁的氧化物的化学式为FeaOb,根据Fe守恒可知0.4 g此氧化物中铁元素的质量为1.0 g×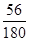 ,氧元素的质量为(0.4g—1.0 g×
,氧元素的质量为(0.4g—1.0 g×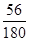 )g,故a:b="(1.0" g×
)g,故a:b="(1.0" g×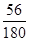 ):(0.4g—1.0 g×
):(0.4g—1.0 g×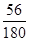 ),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
),解得a:b=1:1,即晶体分解所得铁的氧化物为FeO。至此不难写出草酸亚铁晶体分解的化学方程式为:FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O(或FeC2O4FeO+CO↑+CO2↑)。此后,残留固体的质量逐渐增大,显然是被空气中的氧气所氧化,生成了铁的其他氧化物。由于坩埚是敞口容器,FeO会被空气中的氧气进一步氧化生成铁的其他氧化物,根据图象可知固体质量肯定会大于4.0 g。
本题难度:一般