1、选择题 下列分离、提纯、鉴别物质的方法正确的是( )
A.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
参考答案:A、Fe(OH)3胶体具有丁达尔效应,FeCl3溶液不具备,可以用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液,故A正确;
B、除去NaCl溶液中含有的少量淀粉胶体可以采用渗析的方法,故B错误;
C、硫酸钡和碳酸钡均是难溶于水的物质,用溶解、过滤的方法不能提纯含有少量BaSO4的BaCO3,故C错误;
D、粗盐中的CaCl2、MgCl2等杂质可以转化为沉淀或气体除去,蒸发不能实现分离,故D错误.
故选A.
本题解析:
本题难度:一般
2、填空题 (8分)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:






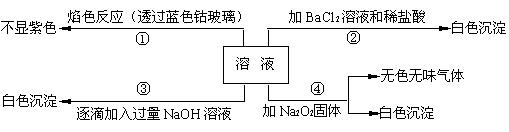 ?(1)在原溶液中一定不存在的离子有?;
?(1)在原溶液中一定不存在的离子有?;
(2)第③个实验中,若取原溶液的体积为100 mL,滴加的NaOH溶液的物质的量浓度为0.5 mol·L-1且生成白色沉淀的量与加入NaOH的量有右图所示的相互关系,则该溶液中所含阳离子的物质的量浓度为?。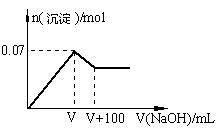
参考答案:
(1)Fe3+、Fe2+、Cu2+、NH4+、K+、CO32-(4分,少1种扣1分,多写一种扣1分,多写两种不得分);
(2)c(Al3+) =" 0.5?" mol·L-1?(2分)?c(Mg2+) =" 0.2?" mol·L-1(2分)
本题解析:略
本题难度:简单
3、选择题 标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
A.0.045 mol/L
B.0.036 mol/L
C.0.026 mol/L
D.0.028 mol/L
参考答案:B
本题解析:试题分析:O2、NO2及水中,完全反应的化学方程式为:4NO2+O2+2H2O=4HNO3。反应后的溶质为硝酸。它的物质的量与二氧化氮的物质的量相等。假设试管的容积为VL,则二氧化氮的体积是(4/5)VL,n(NO2)=(4/5)VL÷22.4L/mol.反应后溶液的体积是Vl.所以C(HNO3)="n/V={(4/5)VL÷22.4L/mol}/VL=(1/28)" mol/L.=" 0.036" mol/L.
考点:考查O2和NO2混合气体与水的反应及溶液浓度的计算的知识。
本题难度:困难
4、选择题 下列混合物分离(或除杂)的方法正确的是( )
A.用CCl4可以从碘水中萃取碘
B.Fe(OH)3中含有少量Al(OH)3可加入适量的HCl除去
C.Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯
D.Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氢氧化钠溶液除去
参考答案:A.碘在萃取剂中的溶解度大于在水中的溶解度,碘单质和水不互溶,且萃取剂和碘不反应,故A正确;
B.Fe(OH)3和Al(OH)3都能与盐酸反应,将原物质除掉,故B错误;
C.NaHCO3不稳定,加热易分解,可用加热的方法除杂,故C正确;
D.二价铁和三价铁离子都能和氢氧化钠反应,将原物质除掉,故D错误.
故选AC.
本题解析:
本题难度:简单
5、填空题 就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
物质
| 熔点/℃
| 沸点/℃
| 密度/g·cm-3
| 溶解性
|
A
| -11.5
| 198
| 1.11
| A、B互溶,且均易溶于水
|
B
| 17.9
| 290
| 1.26
|
?
据此分析,将A和B相互分离的常用方法是:?。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法:?。
参考答案:(1)蒸馏; (2)任意取一层加水,看是否分层,如果不分层,则取的就是水层。分层,则取的就是有机层。
本题解析:根据AB的性质中,沸点相差加大,所以可以用蒸馏将AB分开。分液时有机溶剂和水不混溶。可以用水检验每一层液体是有机溶剂还是水层。
本题难度:一般