1、选择题 能说明醋酸是弱电解质的是
[? ]
① 往碳酸钠溶液中加入醋酸有二氧化碳产生;
② 醋酸钠溶液呈碱性;
③ 可以用食醋清除热水瓶内的水垢;
④ pH=2的醋酸溶液稀释1000倍后pH小于5
A.①③④
B.①②
C.②④
D.②
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列叙述中,不正确的是( )
A.0.1?mol?L-1CH3COOH溶液加水稀释,n(H+)增大
B.0.2?mol?L-1盐酸与等体积0.05?mol?L-1Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3)
参考答案:A、0.1?mol?L-1CH3COOH溶液加水稀释促进弱电解质醋酸的电离,离子浓度减少.n(H+)物质的量增加,故A正确;
B、0.2?mol?L-1盐酸中的氢离子浓度为0.2mol/L,0.05?mol?L-1Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合按照H++OH-=H2O反应后,剩余氢离子浓度=0.2-0.12=0.05mol/L,pH>1,故B错误;
C、依据反应向更难的方向进行,向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI,故C正确;
D、NH4HCO3溶液中的碳酸氢根离子水解促进铵根水解、NH4HSO4溶液中的氢离子抑制铵根离子的水解,NH4NO3溶液中只存在铵根离子的水解,若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则需要溶质的浓度为c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3),故D正确;
故选B.
本题解析:
本题难度:一般
3、填空题 含有一定量CH3COONa和CH3COOH的水溶液称作“缓冲溶液”,在该溶液中加入少量的强酸或强碱时,溶液的pH几乎不变,这可由下列离子方程式来说明:
加入酸时CH3COO-+H+=CH3COOH;加入碱时CH3COOH+OH-=CH3COO-+H2O,
由于CH3COOH和CH3COO-的大量存在,溶液中的c(H+)与c(OH-)基本保持不变.
一定量的H2S和NaHS的溶液也具有缓冲作用,写出在此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加入酸时______;
加入碱时______.
参考答案:定量的H2S和NaHS的溶液中存在HS-、H2S,加入酸时,HS-与酸反应生成H2S,反应的离子方程式为HS-+H+=H2S,加入碱时,H2S反应生成HS-,反应的离子方程式为H2S+OH-=HS-+H2O,
故答案为:HS-+H+=H2S;H2S+OH-=HS-+H2O.
本题解析:
本题难度:一般
4、填空题 2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
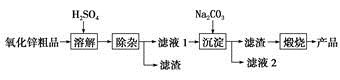
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c(HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
参考答案:(1)焰色反应
(2)102 ∶1
(3)Na2CO3 0.003
(4)6
(5)ZnCO3·2Zn(OH)2·H2O===3ZnO+CO2↑+3H2O↑
本题解析:(1)检验溶液中含有Na+,常用焰色反应。
(2)根据物料守恒,c(Na+)= 2×0.51 mol/L=1.02 mol/L,pH=12,c(OH-)=0.01 mol/L。
(3) 溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3 n(Fe2+)= 0.009 mol, 根据电子得失守恒,则n(KMnO4)=0.003 mol。
(4) )根据信息:当c(Cu2+)·[c(OH-)]2=2×10-20时开始出现沉淀,则c(OH-)=10-8 mol·L-1,pH=6。
本题难度:一般
5、选择题 下列各溶液中,微粒的物质的量浓度关系表述正确的是(?)
A.将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1 :20
B.0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+ c(H2CO3) +2 c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:
c(Na+)+ c(H+)=c(A-) +c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等
参考答案:A
本题解析:B.0.1 mol/L NaHCO3溶液中,由物料守恒可知,c(Na+)=(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.将0.2mol/LNaA溶液和0.1 mol?L-1盐酸溶液等体积混合所得碱性溶液中,溶液不显电性,则由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D.碱抑制水的电离,能水解的盐可促进水的电离,则pH=l2的Ba(OH)2溶液水电离的c(H+)=10-12mol/L,pH=12的Na2CO3溶液中水电离的c(H+)=10-2mol/L,故D错误;
故选A。
点评:本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒、物料守恒、盐的水解及电离等知识即可解答,题目难度中等,选项BC为易错点。
本题难度:简单