1、选择题 关于原电池的叙述中正确的是?
A.构成原电池的电极是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.原电池负极发生的电极反应是还原反应
D.原电池的正极是还原剂,总是溶液中的阳 离子在此被还原
离子在此被还原
参考答案:B
本题解析:略
本题难度:简单
2、计算题 研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组
| 温度℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
CO
| H2O
| H2
| CO
|
1
| 650
| 4
| 2
| 1.6
| 2.4
| 6
|
2
| 900
| 2
| 1
| 0.4
| 1.6
| 3
|
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g)?△H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
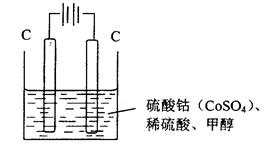
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
参考答案:(12分)(1)①0.13mol/(L?min)(2分) ②放热(1分) ③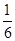 (2分)
(2分)
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l)?△H=-442.8kJ/mol (3分,方程式2分,数值1分)
(3)①Co2+-e-=Co3+(2分) ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+(2分)
本题解析:(1)①根据表中数据可知,氢气的物质的量变化量为1.6mol,因此根据反应的方程式可知,CO2的变化量也是1.6mol,其浓度是1.6mol÷2L=0.8mol/L,所以CO2表示的反应速率是v(CO2)=0.8mol/L÷6min=0.13mol/(L?min)。
②根据表中数据可知,实验1中CO的转化率为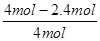 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为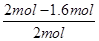 ×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
×100%=20%,因此实验1的转化率大于实验2。这说明温度升高平衡向逆反应方向移动,因此正反应放热。
③平衡时CO的物质的量为1.6mol÷2L=0.8mol/L,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L)? 1? 0.5 ? 0?0
转化浓度(mol/L)? 0.2?0.2?0.2? 0.2
平衡浓度(mol/L)? 0.8?0.3?0.2? 0.2
化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值.所以900℃时该反应平衡常数K=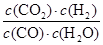 =
=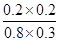 =0.17。
=0.17。
(2)已知反应①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)?△H=-1451.6kJ/mol和反应②2CO(g)+O2(g)=2CO2(g)?△H=-566.0kJ/mol,则根据盖斯定律可知,(①-②)÷2即得CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的反应热△H=(-1451.6kJ/mol+566.0kJ/mol)÷2=-442.8kJ/mol。
(3)①电解池中阳极失去电子,发生氧化反应。因此通电后,Co2+在阳极失去电子氧化成Co3+,所以阳极电极反应式为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而除去,自身被还原为Co2+,结合原子守恒与电荷守恒可知,该反应的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
本题难度:困难
3、填空题 (1)写出一个能证明还原性Fe比Cu强的离子方程式:_______________________;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )
__________________________;
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为
62g,则反应过程中转移电子的数目为_______________________。
参考答案:(1)Fe+Cu2+==Fe2++Cu
(2)
(3)3.01×1023或0.5NA
本题解析:
本题难度:一般
4、选择题 关于如右图所示装置中的叙述正确的是
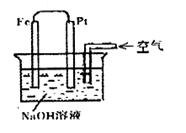
A.这是电解NaOH溶液的装置
B.电子由Fe流向Pt
C.Pt为正极,其电极反应为:2H++2e-=H2↑
D.Fe为负极,其电极反应为:4OH-4e-=2H2O+O2↑
参考答案:B
本题解析:铁的金属性强于Pt的,所以铁是负极,Pt是正极。又因为溶液显碱性,所以属于铁的吸氧腐蚀,因此选项B正确,其余都是错误的,答案选B。
点评:在判断原电池的正负极时,一般主要是依据金属性的强弱,即较活泼的金属作负极,不活泼的金属作正极,据此可以判断。而电极反应式的书写还需要依据电解质溶液。
本题难度:一般
5、选择题 下列说法正确的是
A.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积
D.常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4)
参考答案:A
本题解析:A、根据△G=△H-T·△S可知,反应的自发性与焓变、熵变均有关系。常温下,反应2A (s)+B (g)=2C (g)+D (g)是熵值增加的反应,若不能自发进行,则该反应△H一定大于0,A正确;B、铅蓄电池在放电过程中,负极和正极均有硫酸铅生成,电极均是质量增加的,B不正确;C、水的离子积常数只与温度有关系,因此其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,但水的离子积不变,C不正确;D、碳酸钡是过量的,所以沉淀中一定含有碳酸钡,与盐酸反应放出CO2气体,不能证明碳酸钡的溶度积常数小于硫酸钡的溶度积常数,D不正确,答案选A。
本题难度:一般