1、选择题 使用分液漏斗进行分液时,正确的操作是
[? ]
A.上层液体从漏斗下口放出
B.分离液体时,将漏斗拿在手上进行分离
C.分离液体时,分液漏?斗上的小孔与大气相通时打开活塞
D.若分液时不小心有少量上层液体流下来,补救措施是用滴管将其从烧杯中吸出
参考答案:C
本题解析:
本题难度:简单
2、选择题 在蒸馏实验中,下列叙述不正确的是( )
A.蒸馏烧瓶可直接加热
B.在蒸馏烧瓶中放入几粒沸石,防止暴沸
C.冷水从冷凝管下口入,上口出
D.收集蒸馏水时,应弃去开始馏出的部分液体
参考答案:A
本题解析:
本题难度:一般
3、实验题 【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
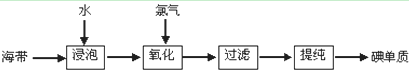
(1)上述生产流程的第一步是“浸泡”,它的实验目的是?;
(2)“氧化”这一操作中可供选用的试剂:Cl2、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂?;
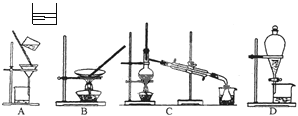
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是(?)(?) (按操作的先后顺序填写);


 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:

(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
?;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是?(填写“游离态”或“化合态”)。解吸后应加入?(填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
参考答案:
(1)使海带中的I-溶解于水中
(2)H2O2
(3)D? C
(4)5Cl2+I2+6H2O =2IO3-+10Cl-+12H+;
(5)游离态? A
本题解析:(1)该实验是从海带中提取碘单质,所以加水浸泡是为了提取海带中的I-;(2)H2O2产物是H2O,是绿色氧化剂;(3)提纯卤素单质一般采用萃取分液,然后蒸馏分离卤素单质与有机溶剂,D为萃取分液装置,C为蒸馏装置;(4)氯气能进一步与碘单质反应,5Cl2+I2+6H2O =2IO3-+10Cl-+12H+;(5)离子交换膜吸附反应生成的碘单质,后被还原解吸和氧化实现碘析。
本题难度:一般
4、填空题 按要求填写相应的除杂试剂,括号内为杂质.
(1)CO2(SO2)______?(2)Cl2(HCl)______
(3)Mg(Al2O3)______?(4)SO2(HCl)______.
参考答案:(1)二氧化硫能与饱和碳酸氢钠反应生成亚硫酸钠与二氧化碳,故答案为:饱和碳酸氢钠;
(2)氯气中的杂质氯化氢能溶于饱和食盐水中,而氯气不能溶于食盐水中,将混合气体通入饱和食盐水中,可以采用洗气的方法来分离,故答案为:饱和食盐水;
(3)镁不与氢氧化钠溶液反应,Al2O3与氢氧化钠溶液反应生成偏铝酸钠和水,故答案为:氢氧化钠溶液;
(4)HCl与饱和亚硫酸氢钠反应生成氯化钠和SO2,故答案为:饱和亚硫酸氢钠.
本题解析:
本题难度:一般
5、填空题 分离沸点不同但又互溶的液体混合物,常用的方法是 ? ;分离固液混合物的常用的方法是 ;分离两种溶解度相差很大的溶质的溶液时,常用的方法是 ? ? ;萃取的条件是 ? 。
参考答案:蒸馏;过滤;蒸发结晶;①某物质在两溶剂中的溶解度相差较大 ②两溶剂不互溶(分层)。
本题解析:考查常见物质的分离方法。结晶法适用于不同溶质的溶解度受温度影响不同而分离的一种方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,所以作为萃取剂的应该满足①某物质在两溶剂中的溶解度相差较大 ②两溶剂不互溶(分层)。
本题难度:简单