1、选择题 下列判断正确的是
A.元素周期表中查得的相对原子质量为同使素的相对原子质量
B.化学键的变化一定会引起化学反应的变化
C.酸性氧化物一定是非金属氧化物
D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
参考答案:B
本题解析:
本题难度:一般
2、选择题 等质量的下列各物质与水反应最平稳、产生H2最多的是
A.Na
B.Li
C.K
D.Rb
参考答案:B
本题解析:因Li的摩尔质量最小,故等质量的四种碱金属中Li与水反应放出H2最多.又因Li的金属性最弱,故与水反应也最平稳.
本题难度:简单
3、推断题 A、B、C、D、E、F属于短周期主族元素。A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零。
(1)B2-的离子结构示意图___________,DE2的电子式___________。
(2)A、B形成的简单离子的半径由大到小的顺序为___________(用具体符号表示)。
(3)由D、F可以构成的最简单的化合物W,取356g分子式为W·9H2O的化合物,将其释放的W完全燃烧生成液态水,可放出1780.6kJ的热量,则W燃烧的热化学方程式为___________________________。
(4)Fe(NO3)3溶液中插入过量EB2反应的离子方程式:__________________________。
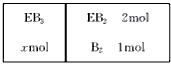
(5)如下图所示,在一定温度下,在一个容积为4L的密闭容器中,左室加入xmolEB3,右室加入2mol
EB2和1mol B2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
左室:2EB3(g) 2EB2(g)+O2(g)
2EB2(g)+O2(g)
右室:2EB2(g)+O2(g)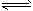 2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
参考答案:(1)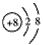 ;
;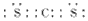
(2)O2->Na+
(3)CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890.3kJ/mol
(4)Fe3++3NO3-+5SO2+4H2O==Fe2++5SO42-+3NO↑+8H+
(5)1/1620(或6.17×10-4)
本题解析:
本题难度:困难
4、选择题 下列元素中,属于第ⅦA?族的是
A.氢
B.氮
C.氧
D.氯
参考答案:D
本题解析:氢是IA族,He是0族,O是ⅥA,所以正确的答案选D。
考点:考查元素周期表的结构
点评:本题的关键是熟练掌握元素周期表的结构并能灵活运用。
本题难度:简单
5、选择题 下列说法中,正确的是( )
A.离子化合物中,阴、阳离子间存在静电吸引力
B.HF、HCl、HBr和HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素对应的含氧酸从左到右以此增强
D.短周期元素形成离子后,最外层电子数都达到8电子稳定结构
参考答案:A.离子化合物中,阴阳离子间不仅存在静电吸引力还存在静电排斥力,故A错误;
B.第VIIA族元素随着原子序数的增大其非金属性逐渐减弱,所以其氢化物的稳定性依次减弱,故B正确;
C.第三周期非金属元素随着原子序数的增大非金属性逐渐增强,所以其最高价含氧酸的酸性逐渐增强,故C错误;
D.短周期元素形成离子后,最外层电子数都达到8电子或2电子稳定结构,如锂离子最外层有2个电子,故D错误;
故选B.
本题解析:
本题难度:简单