1、选择题 将物质的量浓度为Xmol/L的稀盐酸与物质的量浓度为Ymol/L的稀NaOH溶液等体积混合,所得溶液的pH=2(混合后体积为混合前之和),则X和Y的关系是(?)
A.X=Y+0.0l
B.X="2Y"
C.Y="2X"
D.X=Y+0.02
参考答案:D
本题解析:由pH=2知,混合后多余的c(H+)=0.01mol/L,而此时溶液的体积为原来的2倍
本题难度:简单
2、选择题 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。
①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入N aOH的物质的量之间的关系如下图所示。则下列说法正确的是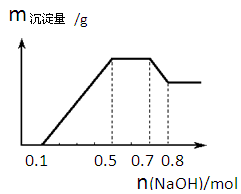
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中一定不含CO32?,可能含有SO42?和NO3?
D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
参考答案:B
本题解析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,其n(NH4+)=0.7mol-0.5mol=0.2mol;由于溶液中还必须存在阴离子,所以一定还有SO42?。根据题型可知,氢离子的物质的量时0.1mol、铝离子的物质的量是0.1mol,但镁离子是(0.5mol-0.1mol-0.3mol)÷2=0.05mol,所以只要选项B正确,答案选B。
点评:该题是高考中的常见题型,难度较大,对学生的综合能力提出了更高的要求。本题有利于培养学生严谨的逻辑思维能力和发散思维能力,特别是结合图像分析的灵活应变能力、该题有利于调动学生的学习积极性,有利于提高学生的学习效率。
本题难度:简单
3、选择题 室温时,在水电离出c(H+)=1.0×10-14mol·L-1的溶液中,一定能大量共存的离子组是
A.K+、Na+、HCO3-、Cl-
B.K+、MnO4-、Br-、Cl-
C.Na+、Cl-、NO3-、SO42-
D.Al3+、NH4+、Cl-、SO42-
参考答案:C
本题解析:水电离出c(H+)=1.0×10-14mol·L-1的溶液可能显酸性,也可能显碱性。
A 碳酸氢根离子既能跟酸反应,也能跟碱反应。
B 在酸性环境中,高锰酸根离子和溴离子不能共存
C 在酸性、碱性都能共存
D 在碱性环境不能共存
本题难度:简单
4、选择题 某溶液中可能含有Na+、Ca2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成:③橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断,在该溶液中肯定都存在的离子组是
A.Na+、Br-、CO32-
B.Na+、SO32-、I-
C.Ca2+、I-、SO32-
D.Ca2+、CO32-、Br-
参考答案:A
本题解析:根据①可知,生成的气泡应该是CO2,即含有CO32-,则没有Ca2+。溶液呈棕黄色,说明有单质溴生成,因此含有溴离子。向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明没有硫酸钡生成,因此就一定不能含有SO32-。橙黄色溶液不能使淀粉溶液变蓝,说明不存在碘离子,由于溶液是电中性的,所以一定含有钠离子,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力。该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
5、选择题 一定能在下列无色溶液中大量共存的离子组是
[? ]
A.c(H+)=1×10-13mol/L的溶液:Na+、Ba2+、HCO3-、SO42-?
B.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
C.在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42-、Cl-
D.加入铝单质能产生大量氢气的溶液:Na+、NO3-、SO42-、Cl-
参考答案:C
本题解析:
本题难度:一般