1、填空题 已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
化学式
| CH3COOH
| H2CO3
| HClO
|
平衡常数
| Ka=1.8×10-5
|  =4.3×10-7 =4.3×10-7
| 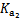 =5.6×10-11 =5.6×10-11
| Ka=3.0×10-8
|
| | | |
|
?
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。?
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(填序号)。?
A.c(H+)? B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)? D.c(OH-)/c(H+)
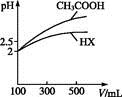
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。?
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值), = 。?
= 。?
参考答案:(1)adcb (2)BD (3)小于 稀释相同倍数,一元酸HX的pH变化比CH3COOH小,故酸性弱,电离平衡常数小 (4)9.9×10-7 18
本题解析:(1)观察电离平衡常数可知酸性为CH3COOH>H2CO3>HClO>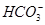 ,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则
,依据越弱越水解,所以得出pH大小顺序为a<d<c<b;(2)稀释溶液中除了c(OH-)增大外,其余均减小,D选项符合;假设平衡不移动,则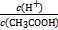 不变,但CH3COOH
不变,但CH3COOH CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=
CH3COO-+H+右移,B选项符合;C选项是水的离子积常数,不变。(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7;由Ka=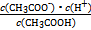 =1.8×10-5可知
=1.8×10-5可知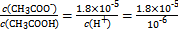 。
。
本题难度:一般
2、选择题 下列各组离子,能在指定溶液中大量共存的是
[? ]
①无色溶液中:K+、Cl-、Na+、HCO3-、OH-
②使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2-
③水电离产生的c(H+)=10-12 mol/L的溶液中:ClO-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤能使甲基橙变红的溶液中:MnO4-、NO3-、Na+、SO42-、Fe3+
⑥pH=0溶液中:Fe2+、Al3+、NO3-、Cl-
A.①③
B.②④⑤
C.①②⑤
D.③⑥
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列各组离子在指定溶液中能大量共存的
A.无色溶液中:K+、Na+、MnO4—、SO42—
B.由水电离出的c (OH— )=1.0× 10-13mol L-1 的溶液中:Na+、Ba2+、Cl—、Br—
C.有较多Fe3+的溶液中:Na+、NH4+、HCO3—、SO42—
D.强酸性溶液中:K+、NH4+、I—、NO3—
参考答案:B
本题解析:A、高锰酸根离子是紫色的,错误;B、由水电离出来的氢离子或者是氢氧根离子的浓度小于十的负七次方,表明水的电离受到了抑制,表明该溶液可能是酸性,也可能是碱性溶液。题中所提供的四种离子,不管是在那一种溶液中,都可以共存。正确;C、三价铁离子存在的溶液,是一个酸性的溶液,碳酸氢根离子不能存在,错误;D、酸性条件下,硝酸根离子能够氧化而碘离子成碘单质,不能共存,错误。
本题难度:一般
4、选择题 下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、OH-
B.Na +、Ca 2+、CO32-、NO3-
C.Na +、H+、Cl-、CO32-
D.K+、Cu2+、SO42-、Cl-