| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《物质的量》高频试题预测(2019年最新版)(四)
参考答案:D 本题解析:因溶液中的离子、分子总数,应包括溶质、溶剂以及由它们相互作用形成的离子,五瓶溶液溶质的浓度比较小,所以微粒数主要取决于溶剂水分子的量,可以用溶液体积直接判断,而溶液体积分别为10、20、30、40、50mL,依次增大.答案选D 本题难度:一般 3、选择题 NA代表阿伏加德常数,下列说法中,正确的是 |
参考答案:D
本题解析:A、在同温同压时,相同体积的任何气体单质所含的分子数相同,但是含有的原子数不一定相同,A错误;B、2g氢气含有2g氢原子,含有2mol氢原子,所含原子数目为2NA,B错误;C、常温下,不是标况下,题中条件无法计算11.2L氮气的物质的量,C错误;D、17g氨气的物质的量为1mol,1mol氨气中含有10mol电子,所含电子数目为10NA;D正确。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般
4、填空题 取20 mL NaOH溶液平均分成两份,分别放入A、B两支试管中。向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下表所示:
| 盐酸体积(单位:mL) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
参考答案:(1)CO2+2OH-=CO32-+H2O;CO2+NaOH=NaHCO3(2)NaOH、Na2CO3(3)0.7(4)112
本题解析:(1)CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,故少量CO2与NaOH溶液反应的离子方程式CO2+2OH-=CO32-+H2O;过量CO2与NaOH溶液反应的化学方程式CO2+NaOH=NaHCO3(2)当n(CO2):n(NaOH)≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;当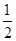 <n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当n(CO2):n(NaOH)≤
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;当n(CO2):n(NaOH)≤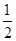 ,反应按②进行,等于
,反应按②进行,等于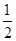 ,时,CO2、NaOH恰好反应生成Na2CO3;小于
,时,CO2、NaOH恰好反应生成Na2CO3;小于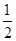 时,生成Na2CO3,NaOH有剩余;,A中通入CO2后所得溶液的溶质为Na2CO3,NaOH(3)加入70ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.07ml×0.1mol/L=0.007mol,所以c(NaOH)=
时,生成Na2CO3,NaOH有剩余;,A中通入CO2后所得溶液的溶质为Na2CO3,NaOH(3)加入70ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液.根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.07ml×0.1mol/L=0.007mol,所以c(NaOH)= 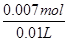 =0.7mol/L,故答案为:0.7mol/L;(4)由曲线B可知从20ml到70ml为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(0.07ml-0.02ml)×0.1mol/L=0.005mol,所以CO2气体体积为0.005mol×22.4L/mol=0.112L=112mL,故答案为112。
=0.7mol/L,故答案为:0.7mol/L;(4)由曲线B可知从20ml到70ml为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(CO2)=n(HCl)=(0.07ml-0.02ml)×0.1mol/L=0.005mol,所以CO2气体体积为0.005mol×22.4L/mol=0.112L=112mL,故答案为112。
本题难度:一般
5、选择题 下列溶液氯离子的物质的量浓度与50?mL?1?mol/LAlCl3溶液中氯离子的物质的量浓度相等的是
[? ]
A.150?mL?1?mol/L氯化钠溶液?
B.75?mL?3?mol/L氯化钙溶液
C.150?mL?3?mol/L氯化钾溶液?
D.50?mL?3?mol/L氯化镁溶液
参考答案:C
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《原子核外电.. | |