1、计算题 现有0.270kg质量分数为20﹪、密度为1.35g/cm3的CuCl2溶液。计算:
(1)该溶液的体积;
(2)该溶液中的CuCl2物质的量;
(3)该溶液中的CuCl2物质的量浓度。
参考答案:(1)V=270g÷1.35g/cm3=200cm3
(2)n(CuCl2)= (270g×20﹪)÷135g/moL=0.2moL
(3)C(CuCl2)= 0.2moL÷0.2L=1moL/L
本题解析:
本题难度:一般
2、计算题 (8分)在50 mL a mol/L的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO)=3 mol/L。
(1)求稀释后的溶液c(H+)= ?。
(2)若a=9,则生成的气体中NO2的物质的量为?mol。?
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入1 mol/L的NaOH恰好被吸收,NaOH溶液的体积为?mL。
参考答案:(1)1?(2)0.125?(3)150
本题解析:(1)溶液中除了有H+、NO3-还有Cu2+,根据电荷守恒可知c(H+)+2c(Cu2+)= c(NO3-),所以c(H+)= 3-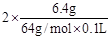 =1mol/L。
=1mol/L。
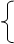
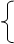 (2)设NO2为xmol,NO为ymol,则? x+3y=
(2)设NO2为xmol,NO为ymol,则? x+3y=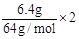 ,?解得? x=0.125mol/L
,?解得? x=0.125mol/L
x+y=9×0.05-3×0.1? y=0.025mol/L
所以NO2的物质的量为0.125mol。
(3)根据原子守恒可知,N原子的量等于Na原子的量,所以NaOH为0.15mol,V(NaOH)=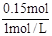 ="0.15L" =150mL。
="0.15L" =150mL。
点评:硝酸与金属反应时,既表现出氧化性,又表现出酸性,根据守恒法计算比较简单。
本题难度:一般
3、选择题 某硝酸的物质的量浓度为c?mol·L-1,溶质的质量分数为a%,则此溶液的密度(g·cm-3)为
[? ]
A.63c/a?
B.6.3a/c
C.6.3c/a?
D.63a/c
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列所得溶液的物质的量浓度等于0.1 mol·L-1的是
A.将0.1 mol氨气充分溶解在1 L水中
B.将10g 1 mol·L-1的硫酸与90 g水混合
C.将8g三氧化硫溶于水并配成1 L溶液
D.将16g CuSO4·5H2O溶于水并配成1 L溶液
参考答案:B
本题解析:水的体积是1L再加氨气溶液的体积应大于1L所以浓度应小于0.1mol/L? A错。B中要使硫酸的浓度减小到0.1mol/L,物质的量不变体积应增大到原来的10倍,因为V=m/ρ加90g水溶液的质量虽然是100g,但密度减小所以体积增大,因此浓度小于0.1mol/L B错。8g三氧化硫恰好是0.1mol体积是1L,因此浓度是0.1mol/L 所以答案应选C。16g CuSO4·5H2O的物质的量小于0.1mol溶于水并配成1 L溶液,浓度也小于0.1mol/L D错。
本题难度:一般
5、填空题 Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式?。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。

(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
参考答案:(10分)
Ⅰ.? NH3+HNO3==NH4NO3? ------ 3分
Ⅱ. (1)? 1:1?3分? (2)? 1 mol·L-1?4分
说明:化学方程式不配平不得分,化学式、关键字、罗马数字写错、元素符号严重不规范、答案写错位置不得分;漏条件、‘浓’字扣1分;不写‘↑’不扣分。
本题解析:Ⅰ.?R为N元素,其最价高氧化物对应的水化物为HNO3,氢化物为NH3,反应生成A的化学方程式为NH3+HNO3==NH4NO3。
Ⅱ.Ⅱ. (1)B→C过程是沉淀Al(OH)3溶解的过程,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+H2O,消耗的NaOH溶液为0.01mol,根据方程式计算Al(OH)3为0.01mol,根据质量守恒定律得Al为0.01mol。A→B过程为生成Mg(OH)2和Al(OH)3的过程,发生反应的离子方程式为Mg2++2OH-= Mg(OH)2↓,Al3++3OH-= Al(OH)3↓,消耗NaOH溶液为0.05mol,根据方程式计算,Al为0.01mol,即Al3+消耗NaOH溶液为0.03mol,则Mg2+消耗NaOH溶液为0.02mol,即Mg2+为0.01mol。根据根据质量守恒定律得Mg为0.01mol。故合金中Mg、Al的物质的量之比为1:1。
(2)Mg、Al合金消耗硫酸的物质的量为0.01mol+0.015mol=0.025mol,根据图像分析,硫酸消耗NaOH溶液为0.03mol,硫酸的物质的量为0.15mol。总硫酸的物质的量为0.04mol故所加硫酸的物质的量浓度为0.04mol÷0.04L=1mol/L。
点评:本题考查镁铝混合物的计算,题目难度不大,注意分析图象曲线的意义,根据物质的性质结合化学方程式计算。
本题难度:一般