1、填空题 (14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
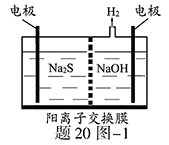
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
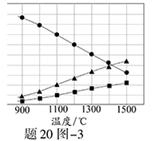
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。

参考答案:
(1)① 2H2O+2e-=H2↑+2OH-
② Sn2-+2H+="(n-1)S↓+" H2 S↑
(2)①Cu、Cl ②0.5mol ③提高空气的比例(增加氧气的通入量)
(3)2H2S 2H2+S2
2H2+S2
本题解析:(1)阴极是水产生的氢离子放电;电解后生成Sn2-,与酸发生歧化反应反应生成硫单质和硫化氢;(2)根据电子守恒,硫化氢电子给了氧气,氧气得电子为0.5mol;增加铁离子含量,使硫化铜被充分氧化,所以需增加氧气使亚铁离子被充分氧化;(3)由图判断生成两种气体体积比为2:1,只能产生S2才符合题意。
考点:本题考查常见离子的大量共存问题。
本题难度:一般
2、选择题 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是

[? ]
A. 断开K2,闭合K1一段时间,溶液的pH变大
B. 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑
C. 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O
D. 断开K1,闭合K2时,OH-向b极移动
参考答案:B
本题解析:
本题难度:一般
3、填空题 塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①______________________________________;②___________________________________。
(2)设通过268 mA的电流60 min后,阴极上沉积出铜0.2879 g,阴极上还可能放出的气体是;该气体在标准状况下的体积是。
参考答案:(1)①Cu2++2e-="===Cu?" ②2H++2e-====H2↑
(2)H2? 1.12×10-2 L
本题解析:(1)得电子能力Cu2+>H+,故阴极上可能发生的反应为:①Cu2++2e-====Cu
②2H++2e-====H2↑
(2)n(e-)=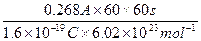 =1.0×10-2 mol
=1.0×10-2 mol
由(1)知生成n(Cu)+n(H2)=n(e-)/2=5.0×10-3 mol
n(H2)=5.0×10-3 mol-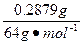 =5.0×10-4 mol,
=5.0×10-4 mol,
V(H2)=5.0×10-4mol×22.4 L·mol-1=1.12×10-2 L。
本题难度:简单
4、选择题 在U形管中,用惰性电极电解硫酸钠和石蕊的混合液,可观察到的现象是()
A.两极附近颜色无明显变化
B.两极均有气体产生,且阳极所产生的气体是阴极的两倍
C.阳极附近的颜色变红
D.阴极附近的颜色变红
参考答案:C
本题解析:略
本题难度:简单
5、选择题 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)  4Na +O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为: 3Fe+4NaOH==Fe3O4+2H2↑+4Na↑。下列有关说法不正确的是
4Na +O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为: 3Fe+4NaOH==Fe3O4+2H2↑+4Na↑。下列有关说法不正确的是
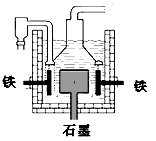
[? ]
A.电解熔融氢氧化钠制钠,阳极发生电极反应为: 2OH--2e-=H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数为1:2
D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极
参考答案:B
本题解析:
本题难度:一般