1、填空题 (4分)完成并配平下列化学方程式□FeO + □HNO3?→ □Fe(NO3)3 + NO↑+ □?,当生成2mol NO时,转移的电子数为?NA。
参考答案:3?10 ?3? 5H2O? 6
本题解析:缺项物质是水。Fe由+2价升为+3价,升高1,N由+5价降为+2价,降低3,所以氧化亚铁和硝酸铁前面配3,一氧化氮前面配1,由氮原子守恒硝酸前面配10,水前面配5。由方程式知当生成1molNO时转移电子3mol。
点评:缺项配平中,所缺物质一般是酸、碱和水,若为离子方程式,所缺物质一般是H+、OH-或H2O。
本题难度:一般
2、选择题 已知溶液中:还原性HSO3—>I—,氧化性:IO3—>I2>SO42—。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是(?)
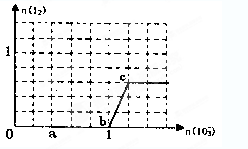
A.a点时NaHSO3过量
B.b点时还原产物为I—
C.b点到c点,KIO3与NaHSO3反应生成I2
D.加入的KIO3为0.4 mol或1.12 mol时,科_I—均为0.4 mol
参考答案:C
本题解析:根据氧化性和还原性强弱顺序可知,首先发生反应5HSO3-+2IO3-=I2+5SO42-+H2O+3H+、H2O+I2+HSO3-=2I-+SO42-+3H+,即3HSO3-+IO3-=I-+3SO42-+3H+、当溶液中HSO3-完全被反应后,又发生反应IO3-+5I-+6H+=3I2+3H2O,所以选项C是错误的,其余都是正确的,答案选C。
本题难度:一般
3、选择题 从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O = 7Cu2S+5FeSO4+12H2SO4下列说法正确的是
A.Cu2S既是氧化产物,又是还原产物
B.产物中的SO42-有一部分是氧化产物
C.5molFeS2发生反应时,有l0mol电子转移
D.FeS2只做还原剂
参考答案:B
本题解析:在反应中CuSO4中是Cu由+2价变成产物Cu2S中的+1价,被还原;FeS2中S为-1价,变成产物Cu2S中的-2价(被还原)和SO42-中的+6价(被氧化)。故Cu2S只是还原产物,A错;产物中的SO42-有一部分是氧化产物,B正确;5molFeS2发生反应时,有3mol的SO42-是被氧化的,共有3×7mol=2lmol电子转移,C错;FeS2既做氧化剂,又做还原剂,D不正确。
本题难度:一般
4、填空题 在氧化还原反应中,氧化过程和还原过程是同时发生的。
Cu2O—2e-+2H+=2Cu2++H2O是一个氧化过程的反应式,下列五种物质FeSO4、Fe2(SO4)2、CuSO4、Na2CO3、KI中的一种能使上述氧化过程顺利发生。
(1)写出并配平该反应的离子方程式:?;
反应中氧化剂和还原剂的物质的量之比是?。
(2)向(1)中反应后的溶液里,加入酸性高锰酸钾溶液,反应的离子方程式为
?;CH2+、MnO4、Fe3+的氧化性由强到弱的顺序是?(用离子符号表示)。
参考答案: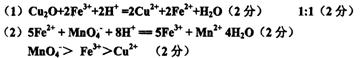
本题解析:略
本题难度:一般
5、填空题 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图?。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是??(填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为?。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为:?。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是?(填序号);
a.7.32 L? b.6.72 L? c.20.16 L? d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为:?。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为?,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH=??(假设电解过程中溶液的体积不变)。
参考答案:(1)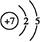 (2)S2->O2->Na+共价键和离子键
(2)S2->O2->Na+共价键和离子键
(3)2Al+2OH-+2H2O=2Al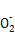 +3H2↑
+3H2↑
(4)ab 3Cu+8H++2N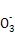 =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
(5)H2+C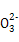 -2e-=CO2↑+H2O ?13
-2e-=CO2↑+H2O ?13
本题解析:由于A和C可形成两种常见的液态化合物,且C的原子序数大,故A为H,C为O,结合C、E为同主族的短周期元素,则E为S;又据A、D最外层电子数相同,故D为Na;再据B、C的最外层电子数之和等于D的原子核外电子数,则B为N。故(1)N的原子结构示意图为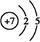 。(2)电子层数越多,离子的半径越大,而电子层结构相同的离子,“核大径小”,故离子半径大小顺序为S2->O2->Na+,由A、B、C三种元素按4∶2∶3组成的化合物是NH4NO3,NH4NO3中含有离子键和共价键。(3)Al和NaOH溶液反应生成NaAlO2和H2,离子方程式为2Al+2OH-+2H2O=2Al
。(2)电子层数越多,离子的半径越大,而电子层结构相同的离子,“核大径小”,故离子半径大小顺序为S2->O2->Na+,由A、B、C三种元素按4∶2∶3组成的化合物是NH4NO3,NH4NO3中含有离子键和共价键。(3)Al和NaOH溶液反应生成NaAlO2和H2,离子方程式为2Al+2OH-+2H2O=2Al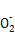 +3H2↑。(4)A、C、E组成的酸为H2SO4,浓H2SO4和Cu反应但稀H2SO4和Cu不反应,故生成SO2的物质的量小于硫酸的一半,根据硫原子守恒知,气体的体积小于20.16 L,故选a、b。若加入NaNO3,提供的N
+3H2↑。(4)A、C、E组成的酸为H2SO4,浓H2SO4和Cu反应但稀H2SO4和Cu不反应,故生成SO2的物质的量小于硫酸的一半,根据硫原子守恒知,气体的体积小于20.16 L,故选a、b。若加入NaNO3,提供的N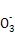 与H+又与Cu反应:3Cu+8H++2N
与H+又与Cu反应:3Cu+8H++2N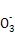 =3Cu2++2NO↑+4H2O。(5)组成的电池是氢氧燃料电池,负极上H2失去电子和C
=3Cu2++2NO↑+4H2O。(5)组成的电池是氢氧燃料电池,负极上H2失去电子和C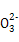 反应生成CO2和水,电极反应式为H2+C
反应生成CO2和水,电极反应式为H2+C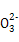 -2e-=CO2↑+H2O。当消耗标准状况下1.12 L H2即n(H2)="0.05" mol,则电解NaCl溶液时消耗H2O电离出的H+的物质的量为0.1 mol,则产生的n(OH-)="0.1" mol,即 c(OH-)=
-2e-=CO2↑+H2O。当消耗标准状况下1.12 L H2即n(H2)="0.05" mol,则电解NaCl溶液时消耗H2O电离出的H+的物质的量为0.1 mol,则产生的n(OH-)="0.1" mol,即 c(OH-)=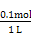 ="0.1" mol/L,所以pH=13。
="0.1" mol/L,所以pH=13。
本题难度:一般