1、计算题 1mol锌与足量的稀硫酸反应,求反应后生成的标准状况下的气体的体积为多少升?
参考答案:22.4L
本题解析:由Zn+H2SO4=ZnSO4+H2↑知可生成1 mol气体,在标状下体积为22.4L
本题难度:一般
2、填空题 (2分)常温常压下CO与H2等体积混合总质量为15g,则混合气体中H2的质量是?g。
参考答案:(2分)1g
本题解析:设氢气和CO的物质的量都是x,则根据n=m/M可知,28g/mol×x+2g/mol×x=15g,解得x=0.5mol。所以氢气的质量是2g/mol×0.5mol=1g。
点评:该题关键是根据阿伏加德罗定律得出氢气和CO的物质的量相等,然后依据条件列式计算即可。
本题难度:一般
3、选择题 下列叙述正确的是( )
A.摩尔是一个便于化学计算的新学习的物理量
B.5.3g碳酸钠中含有的Na+的数目是3.01×1022个
C.瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比是1:2
D.相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压的体积比是1:3
参考答案:C
本题解析:
本题难度:简单
4、计算题 取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀。另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示。试回答下列问题:

(1)加入盐酸后总共产生的气体在标准状况下的体积为__________________L;
(2)盐酸中HCl的物质的量浓度__________________;
(3)反应后的固体的成分(填化学式)__________________;
(4)密闭容器中排出气体的成分(填化学式)______________;
(5)x=_____________。
参考答案:(1)0.448(2分)(2)0.2 mol/L(2分)(3)NaOH? Na2CO3(1分)?
(4)O2?、H2O(2分)(5)6.09g( 3分)
本题解析:(1)3.94g白色沉淀是碳酸钡,物质的量是3.94g÷197g/mol=0.02mol,所以根据碳原子守恒可知,生成的CO2体积是0.02mol×22.4L/mol=0.448L。
(2)由于碳酸钠和盐酸反应是分步进行的,所以根据图像可知,和碳酸氢钠反应的盐酸是275ml-175ml=100ml。所以根据方程式NaHCO3+HCl=NaCl+H2O+CO2↑可知,生盐酸的物质的量是0.02mol,其浓度是0.02mol÷0.1L=0.2mol/L。
(3)由于和碳酸钠反应生成碳酸氢钠时消耗的盐酸是100ml,所以根据图像可知,固体中一定还有氢氧化钠。
(4)根据以上分析可知,氢氧化钠和碳酸钠的物质的量不相等,其中氢氧化钠的少。由于碳酸氢钠分解生成的CO2和水的物质的量是相等的,且过氧化钠首先和CO2反应,所以在反应中过氧化钠不足,水蒸气是过量的,因此排出的气体是氧气和水蒸气。
(5)生成的氢氧化钠是0.2mol/L×0.075mol=0.015mol、碳酸钠是0.2mol/L×0.1mol=0.02mol。所以CO2和过氧化钠反应生成的碳酸钠是0.01mol,则原碳酸氢钠是0.02mol。过氧化钠是0.01mol+0.015mol÷2=0.0175mol。所以每一份中固体的质量是0.02mol×84g/mol+0.0175mol×78g/mol=3.045g,则x=3.045g×2=6.09g。
点评:该题的关键是根据图像准确判断出固体中含有氢氧化钠,另外还需要注意的是由于氢氧化钠能吸收CO2,所以过氧化钠应该首先和CO2反应,最后再和水蒸气反应。在进行计算时,应该根据守恒法,简化计算过程。
本题难度:一般
5、填空题 (7分)生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
成分
| 质量(g)
| 摩尔质量(g/mol)
|
蔗糖
| 25.00
| 342
|
硫酸钾
| 0.25
| 174
|
阿司匹林
| 0.17
| 180
|
高锰酸钾
| 0.25
| 158
|
硝酸银
| 0.02
| 170
|
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为:_______ mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、________________、____________。(在横线上填写所缺仪器的名称)
(4)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次): ;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:__________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线
参考答案:(1)A
(2)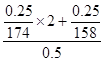
(3)胶头滴管、500mL容量瓶
(4)G→B→C→A→F→E→D
(5)AD
本题解析:(1)A、蔗糖是在水溶液和熔融状态下均不导电的化合物,属于非电解质,正确;B、硫酸钾是在水溶液和熔融状态下均能导电的化合物,属于电解质,错误;C、高锰酸钾是在水溶液和熔融状态下均能导电的化合物,属于电解质,错误;D、硝酸银是在水溶液和熔融状态下均能导电的化合物,属于电解质,错误;故本小题选择A。
(2)在“鲜花保鲜剂”中,含有K+的物质为硫酸钾和高锰酸钾,利用二者的含量进行计算,则有K+的物质的量浓度=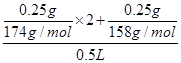 mol/L;
mol/L;
(3)配制480ml一定浓度的溶液时,用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、500ml容量瓶等,其中玻璃仪器有烧杯、玻璃棒、胶头滴管、500ml容量瓶;
(4)配制溶液时,先后顺序分别为计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等步骤,对应到本题顺序,即为G→B→C→A→F→E→D;
(5)A、定容时仰视容量瓶刻度线,会使所得溶液浓度偏低,正确;B、容量瓶在使用前未干燥,里面有少量蒸馏水,对溶液的浓度无影响,错误;C、容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净,会使溶液浓度偏高,错误;D、定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线,导致加入水过多,溶液体积增大,使浓度偏低,正确;故本小题选择AD。
考点:一定浓度溶液的配制方法
本题难度:困难