1、推断题 T?W、X、Y、Z为前四周期元素,其原子序数依次增大.有关五种元索的性质或原子结构描述如下:

(1)W+离子的核外电子排布式为:________;Z元素位子周期表中第____族.
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为________,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于________晶体。
(3)W、X和Y三种元素中,第一电离能最小的为________(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为___________________________(用离予符号表示)。
(4)Z与水蒸气反应的化学方程式为:_______________________________________。
参考答案:
(1)1s22s22p6;VIII
(2)4 :1;离子
(3)Na;Na+< Cl-< S2-
(4)3Fe + 4H2O( 气) Fe3O4+4H2
Fe3O4+4H2
本题解析:
本题难度:一般
2、选择题 某元素气态氢化物的化学式为H2X,则此元素最高氧化物对应水化物的化学式应是( )
A.H2XO3
B.H2XO4
C.H3XO4
D.H6XO6
参考答案:某元素气态氢化物的化学式为H2X,X的最低价为-2价,则最高价为+6价,
A.H2XO3中X的化合价为+4价,故A不选;
B.H2XO4中X的化合价为+6价,故B选;
C.H3XO4中X的化合价为+5价,故C不选;
D.H6XO6中X的化合价为+6价,但不存在此化合物,故D不选;
故选B.
本题解析:
本题难度:简单
3、推断题 A~D为短周期元素,其性质或结构信息如下表所示

请根据表中信息回答下列问题:
(1)A元素在元素周期表中的位置是___________,能说明A单质与D单质氧化性相对强弱的离子方程式为
______________。
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述)______________。
(3)A与C形成化合物的电子式为______________。
(4)D的最高价氧化物对应的水化物的浓溶液的特性有____、 ____、____
(5)B和D形成的化合物只能用干法制取,写出该方法的化学方程式:______________。
参考答案:(1)第三周期ⅦA族;Cl2+S2-=2Cl-+S↓(其他合理答案也可以)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(或铝热反应、铝在冷的浓硫酸或浓硝酸中钝化等)(3) (4)吸水性;脱水性;强氧化性;
(4)吸水性;脱水性;强氧化性;
(5)2Al+3S Al2S3
Al2S3
本题解析:
本题难度:一般
4、简答题 如图是元素周期表的一部分,针对表中的①~⑧八种元素,用元素符号或化学式回答相关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
①
三
②
③
④
⑤
⑥
四
⑦
⑧
|
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为______.
(2)地壳中含量最多的金属元素是______.
(3)用电子式表示①与③形成化合物的过程:______.
(4)这些元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,显两性的是______,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为______.
(5)①②③④四种元素的简单离子核外电子排布相同,都有______个电子,它们的离子半径由大到小顺序是______(用“>”表示).
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是______(用“>”表示).
参考答案:根据元素周期表中短周期元素的分布情况,可以知道①是F,②是Na,③是Mg,④是Al,⑤是Cl,⑥是Ar,⑦是K,⑧是Br.
(1)在这些元素中,化学性质最不活泼的元素的原子是稀有气体元素的原子,即为Ar,原子结构示意图为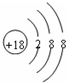 ,故答案为:
,故答案为: ;
;
(2)地壳中含量最多的金属元素是铝,故答案为:Al;
(3)氟化镁是氟离子和镁离子间通过离子键形成的离子化合物,其形成过程为: ,
,
故答案为: ;
;
(4)周期表中从左到右元素最高价氧化物对应水化物的碱的碱性逐渐增减弱,从上到下元素最高价氧化物对应水化物的碱的碱性逐渐增强,所以酸性最强的是HClO4;碱性最强的是KOH;具有两性的是Al(OH)3,既能和强碱反应有能和强酸反应,实质是:Al(OH)3+OH-=AlO2-+2H2O,故答案为:HClO4;KOH;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(5)F-、Na+、Mg2+、Al3+的简单离子核外电子数均为10,核外电子数一样的离子则核电荷数越多半径越小,即F->Na+>Mg2+>Al3+,故答案为:F->Na+>Mg2+>Al3+;.
(6)氟气、氯气、液溴单质的分子量逐渐增大,沸点由高到低的顺序是Br2>Cl2>F2,故答案为:Br2>Cl2>F2.
本题解析:
本题难度:一般
5、填空题 下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题.
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
⑥
⑦
三
①
③
⑤
⑧
四
②
④
⑨
|
(1)③④⑤三种元素金属性最强的是______(填元素符号),⑥⑦⑧三种元素所形成的气态氢化物最不稳定的是______.(填分子式)
(2)金属性最强的单质与水反应的化学方程式是______.
(3)由②⑥⑦三种元素形成的常见化合物的水溶液呈______性(填“酸”、“碱”、“中”),原因是:______(用离子方程式表示).
(4)我国首创的海洋电池以⑤单质为负极,铂网为正极,海水为电解质溶液,⑤单质与⑦单质反应产生电流,其正极反应式为:______.
(5)溶质为8.0g的①的最高价氧化物水化物的稀溶液和溶质为8.0g⑧的氢化物的稀溶液发生反应放出11.46kJ热量,则此反应的热化学方程式为______.
参考答案:由元素在周期表中的位置可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,
(1)同周期随原子序数增大金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故金属性Ca>Mg>Al,非金属性Cl>C、O>C,故氢化物中CH4最不稳定,
故答案为:Ca;CH4;
(2)上述元素中K的金属性最强,与水反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,
故答案为:2K+2H2O=2KOH+H2↑;
(3)由②⑥⑦三种元素形成的常见化合物为K2CO3,属于强碱弱酸盐,溶液中碳酸根水CO32-+H2O?HCO3-+OH-,破坏水的电离平衡,使溶液呈碱性,
故答案为:碱;CO32-+H2O?HCO3-+OH-;
(4)Al与氧气、海水构成原电池,正极发生还原反应,氧气在正极获得电子,中性条件下生成氢氧根,正极电极反应式为:O2+2H2O+4e-=OH-,
故答案为:O2+2H2O+4e-=OH-;
(5)由反应NaOH+HCl=NaCl+H2O,可知NaOH与HCl按质量之比为40:36.5进行反应,故8gNaOH与8gHCl反应时NaOH不足,NaOH完全反应,放出热量为11.46kJ,则1molNaOH反应放出的热量=11.46kJ×1mol×40g/mol8g=57.3kJ,故该反应热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol.
本题解析:
本题难度:简单