|
高考化学知识点整理《盐类水解的原理》考点强化练习(2019年押题版)(六)
2019-07-03 23:49:00
【 大 中 小】
|
1、选择题 在溶液(NH4)2SO4中,离子浓度大小顺序正确的是
A.c(NH4+)> c(SO42-)>c(H+)>c(OH-)
B.c(SO42-)>c(NH4+)>c(OH-)>c(H+)
C.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
D.c(SO42-)>c(H+)>c(NH4+)>c(OH-)
|
参考答案:A
本题解析: (NH4)2SO4是强电解质,完全电离, c(NH4+)接近 c(SO42-)的二倍, 铵根离子水解消耗水电离产生的 OH-,所以 c(H+)>c(OH-);但是盐的水解程度是微弱的,盐的电离远大于弱电解质水的电离,因此c(H+)、c(OH-)都比较小,故:c(NH4+)> c(SO42-)>c(H+)>c(OH-),答案选A。
考点:考查溶液中离子浓度大小的比较。
本题难度:一般
2、填空题 (8分)
I.已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是 。
参考答案:)I. (1)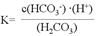 (2分) (2分)
(2)①2HF+CO32-=2F-+H2O+CO2↑ (2分)②CN-+H2O+CO2= HCN+HCO3- (2分)
II. 在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气。(2分)
本题解析:(1)碳酸是二元弱酸,分别电离,碳酸的第一级电离平衡常数表达式: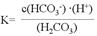 ;(2)①由于酸性HF>H2CO3,所以往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式2HF+CO32-=2F-+H2O+CO2↑;②由于酸性:H2CO3> HCN> HCO3- ,往NaCN溶液中通入少量CO2,发生反应的离子方程式是CN-+H2O+CO2= HCN+HCO3-;II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气,从而得到无水MgCl2。 ;(2)①由于酸性HF>H2CO3,所以往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式2HF+CO32-=2F-+H2O+CO2↑;②由于酸性:H2CO3> HCN> HCO3- ,往NaCN溶液中通入少量CO2,发生反应的离子方程式是CN-+H2O+CO2= HCN+HCO3-;II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气,从而得到无水MgCl2。
考点:考查弱酸的电离平衡常数的应用、离子方程式的书写及盐的水解对物质制取条件的影响的知识。
本题难度:一般
3、填空题 (14分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) 2Fe(s) + 3CO(g) +6H2(g)
参考答案:
本题解析:
本题难度:困难
4、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。 N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)
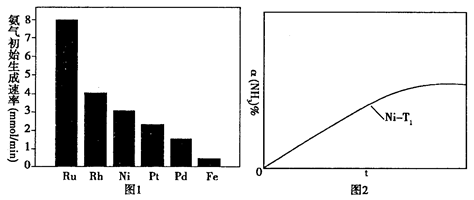
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
参考答案:(10分)(1)①C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-) (2分)②小;(1分)碱(其他合理答案均可)(2分)(2)① Fe (1分) ②见图曲线 Ru-T2  (2分) (2分)
③ 0.12c02(2分)
本题解析:(10分)(1)①当氢氧化钠的体积为20毫升时,反应只生成NaHA,根据图像,溶液显酸性,电离大于水解,所以离子浓度关系为C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-);②当二者等浓度等体积混合时,溶质为NaHA,溶液显酸性,电离大于水解,所以抑制水的电离,水的电离程度比纯水的小;要使溶液显中性,需要加入碱或碱性物质。(2)①氨气分解反应的活化能最大的说明反应速率最慢,从图分析,使用Fe做催化剂时反应最慢。②如果将反应温度提高到T2,Ru催化分解,反应速率加快,先达到平衡,氨气的由于温度升高,促进分解,氨气的分解转化增大,所以曲线为:

③氨气分解的平衡转化率为40%,则分解的氨气的浓度为c0*40%,生成氮气的浓度为c0*40%/2,氢气的浓度为c0*40%*3/2,则平衡常数为(c0×40%/2)(c0×40%×3/2)3/c0-c0×40%)2=0.12c02。
考点:酸碱混合后溶液酸碱性的判断,催化剂对反应速率和平衡的影响,化学平衡常数的计算
本题难度:困难
5、选择题 为了配制NH4+与Cl-浓度比为1∶1的溶液,可在溶液NH4Cl中加入
①适量HCl,②适量NaCl,③适量氨水,④适量NaOH。
A.①②
B.③
C.③④
D.④
参考答案:B
本题解析:在NH4Cl溶液中,由于NH4+水解造成[NH4+]<[Cl-],若[NH4+]=[Cl-],则加入①适量HCl和②适量NaCl,会使[Cl-]更大;加入③适量氨水,由氨水电离使NH4+的浓度增大,可使[NH4+]=[Cl-];加入④适量NaOH,虽对NH4+水解有抑制作用,但毕竟仍有NH4+水解,仍是[NH4+]<[Cl-]。
本题难度:困难
|