1、选择题 下列有关硫及其氧化物的说法正确的是(?)
A.硫俗称硫黄,易溶于水,微溶于酒精和二硫化碳。
B.SO2能使酸性KMnO4溶液或新制氯水褪色,显示了SO2的漂白性。
C.鉴别SO2和CO2可把气体分别通入澄清石灰水中观察现象
D.SO2能与碱反应生成盐和水,说明SO2是酸性氧化物
参考答案:D
本题解析:硫俗称硫黄,微溶于水,易溶于酒精和二硫化碳。A错误。SO2能使酸性KMnO4溶液或新制氯水褪色,显示了SO2的还原性。B错误。鉴别SO2用品红溶液。C错误。
本题难度:简单
2、选择题 下列图象描述正确的是
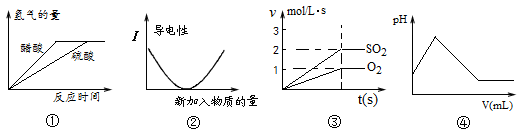
A.图①表示体积和PH值均相同的稀硫酸和醋酸,和足量的镁反应生成H2量的关系
B.图②表示向氨水中滴加醋酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应中,SO2和O2反应速率大小关系
2SO3(g)反应中,SO2和O2反应速率大小关系
D.图④表示向H2S中通入Cl2时,溶液的pH大小变化关系
参考答案:C
本题解析:A、图①生成氢气的量相等,所以镁完全反应,醋酸过量,错误;B、向氨水中滴加醋酸,生成强电解质醋酸铵,开始阶段溶液的导电性增强,错误;C、SO2与O2反应的化学方程式为:2SO2+O2 2SO3,所以v(SO2):v(O2)=2:1,正确;D、Cl2与H2S反应生成S和HCl,弱酸转化为强酸,pH减小,错误。
2SO3,所以v(SO2):v(O2)=2:1,正确;D、Cl2与H2S反应生成S和HCl,弱酸转化为强酸,pH减小,错误。
本题难度:一般
3、计算题 煤是重要的化工原料,用煤作燃料,不仅存在浪费,而且因烟煤中含有硫的化合物(如FeS2),燃烧时会生成SO2气体造成环境污染。
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
参考答案:(1)48 kg? (2)26280 t
本题解析:(1)设产生SO2的质量为x,根据硫元素守恒,得下列关系式:
FeS2? ~? 2SO2
120? 2×64
1 t×103?kg·t-1×5%×90%?x
x="48" kg
(2)由(1)可知1 t煤燃烧时产生SO2 48 kg,即0.048 t,一年烧煤的质量="0.005" t×30×104×365=5.475×105 t
所以一年产生的SO2的质量=5.475×105×0.048 t="26280" t
本题难度:简单
4、实验题 (18分)某同学设计了如下装置用于制取SO2和验证SO2的性质。分流漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3。试回答以下问题:
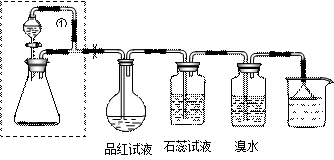
⑴锥形瓶内发生的反应的化学方程式为:?。
⑵实验过程中,品红试液的颜色变为:?;石蕊试液的颜色变化为:?。实验后加热烧瓶,品红试液的颜色变化为:?。
⑶溴水与SO2反应的离子方程式为:?。
⑷导管①的作用是:?;倒置漏斗的作用是?。
⑸方框内装置能否换成启普发生器??(回答“能”或“不能”)。
参考答案:⑴Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(2分) ⑵由红色变为无色(2分);先由紫色变为红色,后颜色逐渐褪去(2分);颜色又恢复为原来的红色(2分)⑶Br2+SO2+H2O=4H++2Br-+SO42-(3分)⑷平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下(3分);防止烧杯内液体倒流入左侧试剂瓶内 (2分)⑸不能(2分)。
本题解析:本题旨在考查SO2的性质及对实验设计的简单理解和评价。⑴⑶都为常见的化学反应,相对简单。⑵由于SO2具有漂白性且其漂白具有稳定性,故品红先变无色,加热后又逐渐恢复为红色。由于SO2不能使指示剂褪色,故其溶液只能表现出酸性而使石蕊变为红色。⑷当方框右侧的多个装置会对SO2的流动造成阻碍作用,故锥形瓶内的压强较大,液体不易流下。由此可以想到导管①的作用是为平衡压强之作用。⑸一方面Na2SO3的晶粒较小,会落入硫酸,另一方面Na2SO3易溶于水,遇到硫酸立即溶解,使反应失去控制,故不能使用启普发生器。
【误区警示】I.SO2的漂白具有选择性,它不能使指示剂褪色,如它只能使石蕊由紫色变为红色 Ⅱ.启普发生器只有同时具备以下条件时才能使用:①反应不需要加热;②反应不会放出大量的热;③反应药品为固体和液体,且固体药品为块状且难溶液于水。
本题难度:一般
5、实验题 实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示:
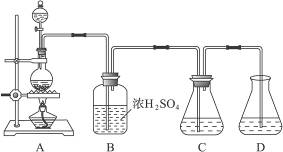
将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
参考答案:(1)取10 mL蒸馏水放在烧杯中,沿烧杯壁将60 mL浓H2SO4缓缓注入水中,同时不断搅拌。
(2)干燥,且可根据放出气体的快慢程度判断SO2的生成速度
(3)充分吸收SO2? 2SO2+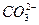 +H2O====CO2↑+
+H2O====CO2↑+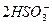
(4)观察B中出现气体的快慢,通过加热控制反应速度,当B中气体放出过快,可移去酒精灯,待缓和后再用小火加热
(5)使NaHSO3转化为Na2SO3
本题解析:浓H2SO4为氧化性酸,与Cu反应生成SO2,SO2的水溶液为H2SO3,H2SO3的酸性比H2CO3强,SO2与Na2CO3溶液作用可产生Na2SO3和CO2,其反应方程式分别为Cu+2H2SO4(浓)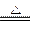 CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。
CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。
本题难度:简单