1、选择题 若以w1和w2分别表示物质的量浓度为a mol/L和b mol/L硫酸的质量分数,且知其2a=b,则下列推断正确的是?
A.2ω1=ω2
B.ω1=2ω2
C.2ω1<ω2
D.ω1<ω2<2ω1
参考答案:C
本题解析:硫酸的质量分数越大,溶液的密度越大,设a mol/L的硫酸的密度为ρ1,b mol/L硫酸的密度为ρ2,则根据物质的量浓度与溶质质量分数的关系: 可得
可得
 ,即得2ω1<ω2
,即得2ω1<ω2
本题难度:一般
2、计算题 (10分)(1)0.5 mol Na2CO3的质量为 g,其中含有 个Na+。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,在相同温度和相同压强条件下,体积最大的是 。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
参考答案:(10分,每空2分)(1)53 NA或6.02X1023 (2)CO2 NH3 (3) 2.5
本题解析:(1)根据m=nM,0.5 mol Na2CO3的质量为0.5mol×106g/mol=53g;再根据N=nNA,可知0.5mol碳酸钠中钠离子的物质的量是1mol,个数是NA;
(2)质量相同的气体含有分子数目的多少取决于物质的量的大小,根据n=m/M,可知质量一定时,物质的量与摩尔质量成反比,所以含有分子数目最少的,其摩尔质量最大,四种气体中,摩尔质量最大的是二氧化碳,所以含有分子数目最少的是CO2;在相同温度和相同压强条件下,体积最大,则其物质的量最大,所以摩尔质量最小,四种气体中摩尔质量最小的是氨气,所以气体体积最大的是NH3;
(3)配制50 mL 0.2 mol/L CuSO4溶液,根据n=cV可知需要硫酸铜的物质的量是0.05L×0.2mol/L=0.01mol,则需要CuSO4·5H2O的质量是0.01mol×250g/mol=2.5g。
考点:考查以物质的量为核心的有关计算
本题难度:一般
3、实验题 实验室配制500mL 0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体(Na2CO3·10H2O)_______g
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为____________
A.调整零点
B.将碳酸钠晶体放入小烧杯中称量
C.称量空的小烧杯
D.将砝码放回砝码盒内
E.记录称量结果
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、_________ 、_________ 、_________ 。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时超过刻度线_________ ;
B.忘记将洗涤液转入容量瓶_________;
C.容量瓶内壁附有水珠而未干燥处理_________;
D.定容后摇匀液面低于刻度线_________ 。
E.转移时有少量液体溅出_________。
参考答案:(1)14.3g?(2)ACBDE?
(3)容量瓶?胶头滴管?玻璃棒
(4)偏低;偏低;不变;不变;偏低
本题解析:考查一定物质的量浓度溶液的配制。
(1)500mL 0.1mol/LNa2CO3溶液至溶质是0.05mol,所以需要Na2CO3·10H2O的质量是0.05mol×286g/mol=14.3g。
(2)考查托盘天平称量时除杂步骤,关键操作要求,答案是ACBDE 。
(3)根据配制要求,还缺少玻璃棒、胶头滴管和500ml容量瓶。
(4)根据c=n/V可进行误差分析。加水时超过刻度线,则溶液体积偏大,浓度偏低;忘记将洗涤液转入容量瓶,溶质偏少,则浓度偏低;容量瓶中含有蒸馏水,浓度不影响;定容后摇匀液面低于刻度线,属于正常的,不影响;转移时有少量液体溅出,溶质偏少,浓度偏低。
本题难度:一般
4、填空题 ① 0.4mol NaCl的质量为?g,64g氧气的含氧原子数目为???。
②在标准状况下,44.8L NH3的物质的量为?,与?克H2S的物质的量相等。?
③1.5mol SO2与? g SO3含有相同质量的氧元素。等质量的CO与CO2含氧元素质量比为?。
参考答案:(6分)①23.4 g;2.408×1024?或4NA②2mol ;68 g?③ 80g?;11:14
本题解析:①根据m=n·M可知,0.4mol NaCl的质量为m=0.4mol×58.5g/mol=23.4g;同样可知,64g氧气的物质的量是64g÷32g/mol=2mol,属于根据氧气的分子式可知,氧原子的物质的量是2×2mol=4mol,则氧原子数目是4NA。
②根据 可知,在标准状况下,44.8L NH3的物质的量为44.8L÷22.4L/mol=2mol;2molH2S的质量是2mol×34g/mol=68g。
可知,在标准状况下,44.8L NH3的物质的量为44.8L÷22.4L/mol=2mol;2molH2S的质量是2mol×34g/mol=68g。
③1.5mol SO2中氧原子的物质的量是1.5mol×2=3mol,则根据三氧化硫的分子式可知,三氧化硫的物质的量是3mol÷3=1mol,其质量是80g。根据CO和CO2的分子式可知,等质量的CO与CO2含氧元素质量比为 。
。
点评:该题是基础性试题的考查,试题注重基础,侧重能力的培养。该类试题学生需要明确的是在进行物质的量的有关计算时,关键是熟练应用几个关系式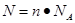 、n=m/M、
、n=m/M、 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
5、填空题 1 molH2O中含有?mol e—
参考答案:10
本题解析:水分子中含有得电子数为1×2+8=10,所以 1 molH2O中含有10mol e—。
本题难度:简单