1、选择题 下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案
A
证明溴乙烷发生消去反应有乙烯生成
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液
B
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
向2mL?1mol/L?NaOH溶液中先加入3滴1mol/L?MgCl2溶液,再加入3滴1mol/L?FeCl3溶液
C
检验蔗糖水解产物具有还原性
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热
D
测定铝箔中氧化铝的含量
取a?g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b?L(已转化为标准状况下)
|
A.A
B.B
C.C
D.D
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列关于各实验装置图的叙述中,正确的是

[? ]
A.装置①可用于制取少量的蒸馏水
B.装置②可用于吸收NH3,并防止倒吸
C.以NaHCO3为原料,装置③可用于实验室制取少量CO2
D.装置④b口进气可收集Cl2
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列实验装置(固定装置略去)和操作正确的是
[? ]
A.
B.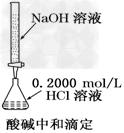
C.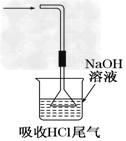
D.
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列实验“操作和现象”与“结论”都正确的是( )
A.操作和现象:切开金属钠,钠表面的银白色会逐渐变暗;结论:Na在空气中会生成Na2O2
B.操作和现象:铝箔插入浓硝酸中,无明显现象;结论:铝与浓硝酸不反应
C.操作和现象:SO2通入滴有酚酞的NaOH溶液,溶液褪色;结论:SO2具有漂白性
D.操作和现象:将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的
处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管;结论:从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示
参考答案:A.钠表面的银白色会逐渐变暗,原因是钠被氧化生成Na2O,Na2O2为淡黄色,故A错误;
B.常温下,铝与浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,而不是不反应,故B错误;
C.二氧化硫为酸性氧化物,与氢氧化钠发生中和反应,故C错误;
D.NO2和水反应生成硝酸和NO,而二氧化氮和氧气通入水中生成硝酸,反应的化学方程式是4NO2+O2+2H2O=4HNO3,故D正确.
故选D.
本题解析:
本题难度:简单
5、简答题 如图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图.

(1)找出在此装置图中出现的错误加以改正______.
(2)实验过程中,在D装置中观察到的实验现象是______;在E装置中观察到的实验现象是______,反应的化学方程式是______;
(3)F装置的作用是______,反应的离子方程式是______.
参考答案:(1)实验室制用浓盐酸和二氧化锰在加热条件下制氯气;除杂时先除去氯化氢,再除去水蒸气,最后收集;氯气的密度大于空气,采用向下排空法收集时应从长管进短管出;
故答案为:稀盐酸改用浓盐酸;B应在A的左边;C中进气管应该长,排气管应该短;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HClO+HCl,盐酸具有酸性,能使紫色石蕊试液变红,次氯酸具有强氧化性,能用于漂白,所以溶液红色褪去,盐酸能与硝酸银反应生成氯化银白色沉淀:HCl+AgNO3=AgCl↓+HNO3,所以在E装置中观察到的实验现象是有白色沉淀生成;
故答案为:溶液先变红后褪色;有白色沉淀生成;Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3;
(3)氯气有毒,为防止污染空气,应用碱液来吸收:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=ClO-+Cl-+H2O.
本题解析:
本题难度:一般