1、填空题 (8分)某有机物A在氧气中充分燃烧只生成CO2和H2O,实验测定A
中C、H、O的质量比为6:1:8,则A的实验式为?;质谱图表明A的相对分子质量为60,则A的分子式为_________________。
(1) 若足量A与Na2CO3反应产生CO2,此反应的化学方程式为:(有机物要求写结构简式)_____________________________________________;
(2) 若A能发生银镜反应,则其结构简式可能是:_______________、__________________。
参考答案:CH2O;C2H4O2;
(1)2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
(2)HCOOCH3或HOCH2CHO
本题解析:C、H、O的质量比为6:1:8,则原子个数之比为 :
: :
: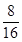 =1:2:1,所以最简式为CH2O。A的相对分子质量为60,则A的分子式为C2H4O2。
=1:2:1,所以最简式为CH2O。A的相对分子质量为60,则A的分子式为C2H4O2。
(1)和碳酸钠反应放出CO2,说明含有羧基,即A是乙酸,方程式为2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2↑。
2CH3COONa+H2O+CO2↑。
(2)A能发生银镜反应,则一定含有醛基,所以其结构简式为HCOOCH3或HOCH2CHO。
本题难度:一般
2、选择题 下列物质一定不能发生加成反应的是?
[? ]
A.C2H6 ?
B.C2H4?
C.C3H6 ?
D.C2H2
参考答案:A
本题解析:
本题难度:简单
3、计算题 某烃类物质0.1mol完全燃烧,将生成物通过浓硫酸,浓硫酸增重7.2克,再将剩余气体通过碱石灰,碱石灰增重13.2克,通过计算,
(1)确定该有机物的最简式
(2)确定该有机物的分子式,写出其结构简式。
(3)该烃标态下对氢气的相对密度为多少
参考答案:方法1.设此烃为CXHY.
CXHY?+ (X+4/Y) O2→XCO2+2/YH2O
1? X+4/Y? X? 2/Y
0.1? 0.3? 0.4
X=3? Y=8
方法2. n(C)= n(CO2)=13.2/44=0.3mol
n(H)="2" n(H2O)=2×7.2/18=0.8mol
n(C) :n(H)=3:8
此烃最简式为C3H8,即此烃为C3H8结构简式为CH3CH2CH3,
标准状况下对氢气的相对密度D= M(C3H8)/M(H2)=(12×3+1×8)/2=22
本题解析:分析题意:某烃类物质0.1mol完全燃烧,浓硫酸增重7.2克,说明生成7.2gH2O;再将剩余气体通过碱石灰,碱石灰增重13.2克,说明二氧化碳的质量是13.2g。所以可计算出水和二氧化碳的物质的量分别为0.4mol、0.3mol,所以1mol该烃分子中含有3molC、8molH,则该烃的分子式为C3H8;最简式也是C3H8;或者计算二氧化碳与水中的C、H原子个数比,得最简式C3H8;碳原子已经饱和,所以最简式也是分子式。结构简式为CH3CH2CH3,根据相对密度定义,计算出标态下对氢气的相对密度是D=M(C3H8)/M(H2)=22.
本题难度:一般
4、选择题 有机物A和B只由C、H、O中的两种或三种元素组成,等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为 ?( ? )
A.0? B.14n
C.18n? D.44n
参考答案:B
本题解析:设烃的化学式为CxHy,燃烧的化学方程式为CxHy+(x+y/4)O2 xCO2+ y/2H2O,等物质的量的烃完全燃烧耗氧量由(x+ y/4)值决定,x+ y/4)的值越大,消耗氧气的量就越多,若两种烃的x+ y/4值相等,耗氧量就相同,物质的量相等的烃CxHy和完全可拆成形式为CxHy?(CO2)m?(H2O)n的烃的衍生物分别完全燃烧后,它们消耗的O2的量相同.
xCO2+ y/2H2O,等物质的量的烃完全燃烧耗氧量由(x+ y/4)值决定,x+ y/4)的值越大,消耗氧气的量就越多,若两种烃的x+ y/4值相等,耗氧量就相同,物质的量相等的烃CxHy和完全可拆成形式为CxHy?(CO2)m?(H2O)n的烃的衍生物分别完全燃烧后,它们消耗的O2的量相同.
A、A和B相同时,A和B的分子量相差0的倍数,故A正确;
B、当A和B相差n个-CH2-时,不符合题意,故B错误;
C、如果A和B的分子组成相差若干个H2O,耗氧量不变,故C正确;
D、如果A和B的分子组成相差若干个CO2,耗氧量不变,故D正确。
故选B。
点评:本题考查有机物的燃烧耗氧量的计算,题目难度不大,注意燃烧的化学方程式得出等物质的量的烃完全燃烧耗氧量由x+y/4值决定。
本题难度:一般
5、填空题 [江苏省南通中学2008学年度第一学期期末复习高三化学 ].某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。

(1)简述两套方案各自的优点:甲:_________________、_________________________,
乙:___________________
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(3)若要保证此实验有较高的效率,还需补充的仪器有__________。理由______。
(4)实验中能验证乙醇氧化产物的实验现象是_______________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式____________。
参考答案:(1)甲: ①中用分液漏斗可以控制液体的流量,控制反应的进行;
②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;
②中的斜、长导管起到冷凝回流乙醇蒸汽的作用?(三点中答出两点即可,2分)
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证
(2分)
(2)乙①;甲②;乙③?(3分)
(3)温度计(2分);控制水浴温度在78 ℃或略高于78 ℃,使乙醇蒸汽平稳流出,减少挥发,提高反应效率 (2分)
(4)c处无水硫酸铜变蓝;d处生成红色沉淀 (2分)
(5) ?(2分)
?(2分)
本题解析:根据实验目的和两套试验装置的比较可以获得结论。
本题难度:简单