| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《物质的量》高频试题特训(2019年最新版)(四)
参考答案:C 本题解析:A.温度相同、体积相同但是气体的压强不移动相同,所以O2和N2,两种气体的分子数不一定相等,错误;B.体积相等、密度不等的CO和C2H4的质量不相同,而CO和C2H4的相对分子质量相同,所以分子数不等,错误;C.N2和C2H4摩尔质量相等,气体的质量相等,则气体的物质的量就相等,所以分子数也就相等,正确;D.压强相同、体积相同的N2和O2的温度不移动相等,所以分子数就不一定相等,错误。 本题难度:一般 2、选择题 相同温度和压强下,3体积的X2气体与6体积的Y2气体化合生成6体积的气态化合物A,则生成物A的化学式为 ( ) |
参考答案:A
本题解析:相同温度和压强下,气体的体积之比等于物质的量之比,等于化学反应方程式的系数之比,所以3体积的X2气体与6体积的Y2气体化合生成6体积的气态化合物A,可以表示为:3X2+6Y2=6A,根据原子守恒,所以A为XY2.答案选A.
考点:阿伏伽德罗定律
本题难度:一般
3、填空题 用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
(1)所需浓H2SO4的体积为______
(2)实验室除用到量筒、烧杯、玻璃棒外,实验中还需要用到的仪器有______.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容______.
②定容时俯视刻度线______.
(4)若定容时液面高于刻度线应采取的措施是______.
参考答案:(1)浓H2SO4的物质的量浓度c=1000×1.84×98%98mol/L=18.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6mL;?
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:胶头滴管、500mL容量瓶.
故答案为:胶头滴管、500mL容量瓶;
(3))①浓硫酸溶解后未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,浓度偏高,故答案为:偏高;
②定容时俯视刻度线,溶液体积偏小,浓度偏高,故答案为:偏高;
(4)因实验操作过程中一旦出现错误必须重新配制,故答案为:重新配制.
本题解析:
本题难度:简单
4、选择题 将40克NaOH溶于水中,配制成1L溶液,则该溶液的物质的量浓度为
A.0.1mol/L
B.0.5mol/L
C.4mol/L
D.1mol/L
参考答案:D
本题解析:分析:根据溶质的质量计算溶质的物质的量,根据c= 计算溶液的物质的量浓度.
计算溶液的物质的量浓度.
解答:n(NaOH)=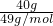 =1mol,
=1mol,
则c= =
= =1mol/L.
=1mol/L.
故选D.
点评:本题考查物质的量的有关计算,题目难度不大,注意物质的量与质量、浓度的计算公式的运用.
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.1mol过氧化钡(BaO2)晶体中所含有的阴离子数目为2NA
B.标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA
C.将Imol FeCl3转化为氢氧化铁胶体,得到的氢氧化铁胶体粒子数小于NA
D.常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA
参考答案:C
本题解析:A、过氧化钡晶体中阴阳离子的个数之比是1:1,所以1mol过氧化钡(BaO2)晶体中所含有的阴离子数目为NA,A不正确;B、标准状况下,四氯化碳不是气体,不能适用于气体摩尔体积,B不正确;C、铁离子水解生成氢氧化铁胶体,水解是可逆的,因此将Imol FeCl3转化为氢氧化铁胶体,得到的氢氧化铁胶体粒子数小于NA,C正确;D、常温常压下,33.6L氯气的物质的量不是1.5mol,不能确定反应中转移电子的个数,D不正确,答案选C。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《碳族元素》.. | |