1、选择题 下列反应的离子方程式书写正确的是?(?)
A.含1molFeCl2的溶液中通入1molCl2 Fe2++Cl2=Fe3++2Cl-
B.NaClO溶液中通入过量的SO2气体 ClO-+SO2+H2O
C.在足量热的稀硫酸中不断通入空气氧化废铜 2Cu+O2+4H+=2Cu2++2H2O
D.工业上将硫酸工业尾气SO2持续通入氨水中 SO2+OH-=HSO3一
参考答案:C
本题解析:A 错误,未配平
B 错误,次氯酸有强的氧化性,会把亚硫酸根离子氧化为硫酸根离子
C 正确。
D 错误,氨水应写成分子形式,不能写OH-离子形式
本题难度:一般
2、选择题 下列反应的离子方程式正确的是
[? ]
A.铝片跟氢氧化钠溶液反应:Al+2OH-==== AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42- + Ba2+ ====BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH====Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应Cu+NO3-+4H+====Cu2++NO↑+2H2O
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列离子方程式正确的是
[? ]
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-?=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-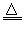 H2O+NH3↑
H2O+NH3↑
C.氢氧化镁与稀硫酸反应:H+?+OH-?=H2O
D.单质铜与稀硝酸反应:Cu+2H+?+2NO3-=Cu2+?+2NO↑+H2O
参考答案:B
本题解析:
本题难度:一般
4、填空题 Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是?__。
(2)检验溶液B中是否存在Fe3+的方法是?__。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是?。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| 氨水物质的量浓度/(mol·L-1)
| 盐酸物质的量浓度/(mol·L-1)
| 混合溶液pH
|
①
| 0.1
| 0.1
| pH=5
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH>7
|
?
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=?__mol·L-1;从第②组情况表明,c?__(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+)?__(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序?__>?__>?__>?__(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
参考答案:Ⅰ.(1)防止铁盐、铜盐发生水解反应
(2)取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+
(3)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
(4)1×10-5 > >
(5)B D A C
本题解析:(3)CuSO4溶液中加入一定量的Na2SO3和NaCl,若生成CuCl沉淀,根据元素的化合价变化可知,SO32-会被氧化为SO42-。(4)①组中,氨水与盐酸恰好反应,生成的氯化铵发生水解反应,促进了水的电离,由水电离出的c(H+)=1×10-5 mol·L-1;第②组所得溶液显中性,若等浓度混合,则溶液显酸性,故若显中性,则应该是碱稍过量,即氨水的浓度大于0.2 mol·L-1;根据计算可得,混合后所得溶液中含有等浓度的NH3·H2O和氯化铵,由于pH>7,故氯化铵的水解程度小于NH3·H2O的电离程度,故c(NH4+)>c(NH3·H2O)。(5)氯化铵是强电解质,完全电离,而NH3·H2O是弱电解质,部分电离,故C中的c(NH4+)最小;而B中同时含有氯化铵和NH3·H2O,且该混合溶液中NH3·H2O的电离大于氯化铵的水解,故B中的c(NH4+)最大;D中存在的氯化氢抑制了NH4+的水解,故A中的c(NH4+)小于D中的,所以c(NH4+)的大小关系是B>D>A>C。
点拨:本题考查铁、铜及其化合物的性质、离子浓度的比较,考查考生灵活解决问题的能力。难度较大。
本题难度:困难
5、选择题 下列离子方程式正确的是( )
A.氢氧化钡溶液与盐酸的反应:OH-+H+=H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑
参考答案:A、氢氧化钡溶液与盐酸的反应是强酸和强碱反应生成可溶性的盐和水的反应,实质是氢离子和氢氧根离子之间的反应,即OH-+H+=H2O,故A正确;
B、澄清的石灰水与稀盐酸反应的实质是:OH-+H+=H2O,故B错误;
C、金属铜可以将银从溶液中置换出来,Cu+2Ag+=Cu2++2Ag,故C错误;
D、碳酸钙是难溶于水的沉淀,不能拆成离子形式,碳酸钙和盐酸的反应为:CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误.
故选A.
本题解析:
本题难度:简单