1、选择题 下列实验操作中错误的是
[? ]
A.过滤时滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡
B.使用试管夹,应从试管底部往口部套,夹在试管的中上部
C.用规格为20mL的量筒量取6mL的液体
D.实验室制氧气之前,先检查装置的气密性,再装入药品
参考答案:C
本题解析:
本题难度:简单
2、选择题 实验室中要配制1.00mol/L的Na2CO3溶液480 ml,配制时应选用的容量瓶的规格和称取的Na2CO3的质量分别是
A.480 ml ,50.9 g
g
B.500ml, 53.0g
C.500 ml, 53g
D.1000ml, 106.0g
参考答案:B
本题解析:略
本题难度:简单
3、选择题 用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是
A.将5.85gNaCl固体溶于1 L水中可配成0.1 mol·L-1的NaCl溶液
B.称量时,将固体NaCl直接放在天平左盘上
C.固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线
D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果
参考答案:D
本题解析:考查溶液的配制
A:溶于1升水中是错误的,应溶于水中配成一升溶液
B:固体一般放在纸片上
C:溶解后洗涤烧杯二至三次,一并移至容量瓶中,加水稀释到离刻度线2至3cm时,改用胶头滴管定容,不正确
D:正确
答案为D
本题难度:简单
4、选择题 实验室用12 mol/L的浓盐酸配制0.1 mol/L的稀盐酸250 mL,不需要的仪器是( )
A.胶头滴管
B.托盘天平
C.玻璃棒
D.量筒
参考答案:B
本题解析:用浓溶液配制稀溶液时,不需要用到托盘天平,托盘天平是用来称量固体的质量的。
本题难度:简单
5、填空题 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO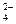 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
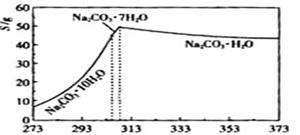
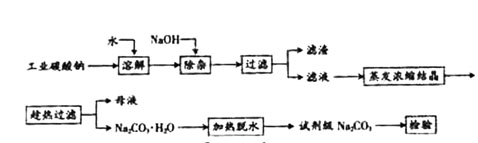
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
小题1:(1)滤渣的主要成分为 。
小题2:(2)“趁热过滤”的原因是 。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是 。
小题5:(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)?ΔH1=" +532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H?2O(g)?ΔH1=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
参考答案:
小题1:(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
小题2:(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
小题5:(5)写出Na2CO3·H2O脱水反应的热化学方程式
Na2CO3·H2O(S)="===" Na2CO3(s) + H2O(g);H= +58.73kJ/mol
本题解析:
小题1:(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
小题2:(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
小题3:(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
小题4:(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
小题5:(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(s)="===" Na2CO3(s)+ H2O(g)。
本题难度:一般