|
高考化学试题《物质的量》高频考点强化练习(2019年最新版)(四)
2019-07-04 00:10:23
【 大 中 小】
|
1、选择题 物质的量相等的两种气体,必然具有相同的( )
A.体积
B.分子数
C.原子数
D.密度
|
参考答案:B
本题解析:略
本题难度:一般
2、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是(?)
A.22.4LH2含氢分子数为6.02×1023
B.32gO2中含有的氧原子数为2×6.02×1023
C.0.1mol/L NaCl溶液中,含Na+的数目为6.02×1022
D.标准状况下,22.4L H2O含水分子数为6.02×1023
参考答案:B
本题解析:A中未指明所处的条件,则22.4L不一定是1mol,故A错误;
B中,N(O)=32g/32g.mol-1×6.02×1023×2,故B正确;
C中溶液体积不知道,则无法求算Na+的数目,故C错误;
标准状况下,H2O为液体,则不能使用Vm,故D错误;
本题难度:简单
3、填空题 实验室欲配制250mL?0.2mol?L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒?②胶头滴管?③托盘天平?④药匙?⑤烧瓶?⑥烧杯
(1)通过计算可知,应用托盘天平称取______g碳酸钠晶体(Na2CO3?10H2O).
(2)配制过程需要的仪器______(填序号),还缺少的仪器有______.
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)______;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3?10H2O晶体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”).若没有进行A操作______;若定容时俯视刻度线______.
参考答案:(1)需十水合碳酸钠的质量为m=0.25L×0.2mol?L-1×286g/mol=14.3g,故答案为:14.3;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管、药匙,
故答案为:②③④⑥(①可有可无);?250mL容量瓶,玻璃棒;
(3)由(2)中溶液的实验操作过程可知,正确的操作顺序是BCAFED,故答案为:BCAFED;
(4)未洗涤烧杯、玻璃棒,少量碳酸钠沾在烧杯壁与玻璃棒上,碳酸钠的实际质量减小,溶液浓度偏低;
定容时,俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高.
故答案为:偏低;偏高.
本题解析:
本题难度:一般
4、计算题 某厂平均每天产生约600 m3废氨水(NH3的浓度为153 mg·L-1,密度为1 g·cm—3。
(1)该废氨水中氨的物质的量浓度为?。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3 的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为?。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2 →2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
NaOH 溶液体积/mL
| 40.00
| 40.00
| 40.00
| 样品质量/g
| 7.75
| 15.50
| 23.25
| 氨气质量/g
| 1.87
| 1.87
| 1.7
|
?
试计算生成氨气的质量最大时样品的质量。
参考答案:(1)9×10-3 mol·L-1 (2分)
(2)n(NH3)= ×10-3g/mg×600m3×103L/m3="4800" mol? (3分) ×10-3g/mg×600m3×103L/m3="4800" mol? (3分)
(3)①0.14 (3分)
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+? 5O2 →4NO+6H2O ?4NH3 + 3O2 →2N2+6H2O
4? 5? 4? 3? 2
X? 5x/4? y? 3y/4? y/2
X+y=1? (2-5x/4-3y/4):(8+y/2)=1:10? x="0.89" (4分)
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)="0.13/12=" n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol
混合物质量为8.40g。(4分)(其他合理解法也给分)
本题解析:(1)进行单位变换:C(NH3)=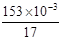 =9×10-3 mol·L-1。(2)n(NH3)= =9×10-3 mol·L-1。(2)n(NH3)= ×10-3g/mg×600m3×103L/m3="4800" mol? (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为: ×10-3g/mg×600m3×103L/m3="4800" mol? (3分)(3)①氨和氧气的体积比为4:5,氨和空气的比值为4:25,则氨所占比例为: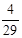 =0.14。 =0.14。
②设参加主反应NH3的为xmol,副反应的NH3为ymol
4NH3+? 5O2 →4NO+6H2O ?4NH3 + 3O2 →2N2+6H2O
4? 5? 4? 3? 2
X? 5x/4? y? 3y/4? y/2
X+y=1? (2-5x/4-3y/4):(8+y/2)=1:10? x="0.89"
(4)7.75g混合肥料中n[(NH4)2SO4]=0.05mol,n(NH4HSO4)=0.01mol;则混合物溶解后,溶液中n(NH4+)∶n(H+)=11∶1。40.00 mL NaOH 溶液中n(NaOH)=0.13mol。n(H+)+ 11×n(H+)=0.13mol;n(H+)="0.13/12=" n(NH4HSO4),n[(NH4)2SO4]= 5×0.13/12mol,混合物质量为8.40g。
本题难度:一般
5、选择题 NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.80g硝酸铵中含有氮原子数为NA
B.1molC3H8分子中共价键总数为11NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.0.1molN5+离子中所含的电子数为3.4NA
|