1、选择题 摩尔是( )
A.物质的数量单位
B.表示物质的质量单位
C.表示物质的量的单位
D.既是物质的数量单位又是物质的质量单位
参考答案:C
本题解析:
本题难度:简单
2、选择题 某化合物由A、B两元素组成,已知A、B两元素的质量比为7:4,原子量之比为7:8,则此化合物分子式可能是( )
A.A2B
B.AB
C.AB2
D.A2B5
参考答案:A
本题解析:
本题难度:简单
3、计算题 19世纪有些化学家测定某元素R的相对原子质量时,采用的方法是:用等容积的烧瓶4只,分别盛入N2,X、Y、Z四种气态物质,操作时先把烧瓶抽成真空,充气后使压强达到1.01×105 Pa,保证气体充满整个烧瓶,并称得每只烧瓶重,减去真空的瓶重而得到瓶内气体的质量(换算成标准状况),得到的数据如下表所示,将X、Y、Z气体中某元素R的质量分数也分别用实验测定,列入下表。
气体
| 瓶中气体质量/g
| R(%)
| 气体
| 瓶中气体质量/g
| R%
|
N2
| 0.652
| -
| Y
| 2.398
| 68.9
|
X
| 0.849
| 97.4
| Z
| 3.583
| 92.2
|
气体
| 瓶中气体质量/g
| R(%)
| 气体
| 瓶中气体质量/g
| R%
|
N2
| 0.652
| -
| Y
| 2.398
| 68.9
|
试回答:R的相对原子质量是多少?
参考答案:35.5
本题解析:(1)n(N2)=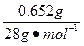 ="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:
="0.023" 3 mol,根据阿伏加德罗定律知同温、同压下同体积的各种气体,其物质的量相等,故计算如下:
气体 摩尔质量/g·mol-1
1 mol气体中R的质量/g
X 0.849/0.023 3=36.4
36.4×97.4%=35.5
Y 2.398/0.023 3=102.9
102.9×68.9%=70.9
Z 3.583/0.023 3=153.8
153.8×92.2%=141.8
因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1 mol化合物中至少含1 mol R原子,故元素R的相对原子质量为35.5。
本题难度:简单
4、选择题 NA为阿伏加德罗常数,下列说法正确的是?
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA
参考答案:D
本题解析:略
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA