| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《常见的化学电源》练习题(四)
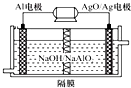 参考答案:A.由总反应式可知OH-参加反应,应用阴离子交换膜,故A错误; 本题解析: 本题难度:简单 4、选择题 燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x?极:O2(g)+2H2O(l)+4e-→4OH-y极:2H2(g)+4OH--4e-→4H2O(l)+,判断下列说法中正确的是( ) 参考答案:x?极:O2(g)+2H2O(l)+4e-→4OH-,该反应中O2得电子被还原,应为原电池的正极反应,则x为正极; 本题解析: 本题难度:简单 5、选择题 实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应: 参考答案:C 本题解析:要求得硫酸的量,需首先找出铅蓄电池的总反应。将上述两个电极反应合并可得:Pb+PbO2+2H2SO4=2PbSO4+2H2O。而在制取Cl2时,每生成1 mol Cl2,电子转移2 mol,现需要转移电子0.050 mol×2=0.100 mol。由铅蓄电池总反应可知,每转移0.100 mol电子,将消耗0.100 mol硫酸。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《磷及其化合.. | |