1、选择题 通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实能作为这个规则证据的是(?)。
A.元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
B.氟的电负性大于氧的电负性
C.基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
D.某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2
参考答案:C
本题解析:略
本题难度:简单
2、选择题 对于VIIA族元素,下列说法不正确的是
A.可形成-l价离子
B.从上到下原子半径逐渐减小
C.从上到下原子半径逐渐增大
D.从上到下非金属性逐渐减弱
参考答案:B
本题解析:第VIIA族元素最外层电子数是7个,容易形成-1价离子,A正确;同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,因此选项B不正确,CD都是正确的,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是熟练记住元素周期表的结构,灵活运用元素周期律即可,有利于培养学生的逻辑推理能力,提高学生的应试能力。
本题难度:简单
3、选择题 A、B、C、D、E是短周期五种元素,其原子序数逐渐增大。其中A与C是同族元素,B、E两元素间可形成酸雨,B、D简单离子具有相同的核外电子排布结构。下列说法正确的是(?)
A.氢化物的沸点:B<E?
B.简单离子半径:B>D
C.元素A与元素B不能形成化合物A2B2,但元素B与C能形成化合物C2B2?
D.元素D最高价氧化物一定能溶于强碱溶液
参考答案:B
本题解析:A、B、C、D、E原子序数逐渐增大,B、E两元素间可形成酸雨,所以B为O。E为S。B(氧离子)、D简单离子具有相同的核外电子排布结构,所以D为第三周期的金属元素镁或者铝。A与C是同族元素,C的原子序数比氧大,所以C为第三周期元素Na,A为H。A项,水分子间存在氢键,故沸点大于硫化氢。A错误。B项,核外电子排布相同的离子,原子序数越大,离子半径越小,所以B正确。C项,元素A与元素B能形成化合物H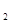 O
O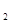 ,故C错误。D.元素D最高价氧化物可能是氢氧化镁,也可能是氢氧化铝,只有氢氧化铝能溶于强碱溶液,故D错误。选B
,故C错误。D.元素D最高价氧化物可能是氢氧化镁,也可能是氢氧化铝,只有氢氧化铝能溶于强碱溶液,故D错误。选B
本题难度:一般
4、选择题 A 和 B 是同周期的相邻元素, B 和 C 是同主族的相邻元素,且A、B、C 最外层电子数之和为 19,则A、B、C三种元素分别是?(?)
A.N、 F、 Cl? B.F、 O 、S? C.S、 Cl 、O? D.S 、O 、F
参考答案:B
本题解析:考查元素周期表的结构。本题可以采用排除法,A中N和F不相邻。C中Cl和O不是同主族的,D中O和F也不是同主族的,所以正确的答案是B。
本题难度:一般
5、选择题 X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其最内层电子数的2倍,Y原子的最外层电子数比W原子的少2个。下列叙述一定正确的是
A.X、Y的单质均可以导电
B.原子半径:Z>W
C.X、Z的氧化物均为酸性氧化物
D.Y、W的最高价氧化物的水化物均易溶于水
参考答案:B
本题解析: X最外层电子数是内层电子数的2倍可推出X为C,X与Z同主族可推出Z为Si,W比Y多2个电子,可推出W为P、Y为Al。
A、铝能导电、碳元素形成的单质石墨可以导电,金刚石和C60不能导电,错误;B、同周期从左向右,原子半径减小,原子半径:Si>P,正确;C、二氧化硅、二氧化碳是酸性氧化物,CO是不成盐氧化物,错误;D、氢氧化铝和硅酸均不溶于水,错误。
本题难度:一般